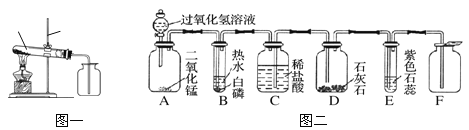
题目内容
【题目】(9分)“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用。实际生产中,常利用NaOH溶液来“捕捉”CO2,过程如下图所示(部分条件及物质未标出)。
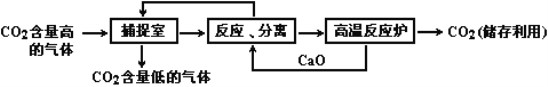
(1)捕捉室内反应的化学方程式为____________________。
(2)“反应分离”中反应的化学方程式为_____________________;__________________。
分离所采用的操作方法是 __________________________。
(3)该生产过程中,没有涉及的基本反应类型的是_______________。
(4)下列有关该捕捉过程的叙述正确的有__________________。
A.捕捉到的CO2可制备其它化工产品,减少了温室气体排放
B.“反应分离”中的反应要吸收大量热
C.整个过程中,只有一种物质可循环利用
D.能耗大是该捕捉技术的一大缺点
【答案】(1)CO2+2NaOH=Na2CO3+H2O。
(2)CaO+H2O=Ca(OH)2、 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 、过滤 ;
(3)置换反应;
(4)A D。
【解析】
试题分析:(1)氢氧化钠溶液能吸收大量的二氧化碳,生成碳酸钠和水;
(2)氧化钙与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应,生成碳酸钙沉淀和氢氧化钠;分离时将沉淀除去应该采用过滤的操作方法;
(3)CaO+H2O=Ca(OH)2属于化合反应;Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 属于置换反应;高温反应炉中碳酸钙高温分解产生氧化钙和二氧化碳,属于分解反应,所以该生产过程中没有涉及到置换反应。
(4)A.捕捉到的CO2可制备其它化工产品,减少了温室气体排放,正确;B、“反应分离”中是碳酸钠和氢氧化钙反应,常温即可,错误;C、整个过程中,碳酸钙和氢氧化钠都可以循环利用,错误;D、能耗大是该捕捉技术的一大缺点,正确。故选AD