题目内容
某碳酸镁样品含有少量杂质(杂质不溶于水也不与酸反应),取15g碳酸镁样品与一定量的稀盐酸,恰好完全反应,得到6.6g气体和115.5g不饱和溶液.请计算:
(1)碳酸镁样品中碳酸镁的质量分数是多少?
(2)参加反应的稀盐酸中溶质的质量分数为多少?
(1)碳酸镁样品中碳酸镁的质量分数是多少?
(2)参加反应的稀盐酸中溶质的质量分数为多少?
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:碳酸镁和稀盐酸反应生成氯化镁、水和二氧化碳,根据二氧化碳的质量可以计算碳酸镁的质量和氯化氢的质量,进一步可以计算碳酸镁样品中碳酸镁的质量分数和参加反应的稀盐酸中溶质的质量分数.
解答:解:(1)设碳酸镁的质量为x,稀盐酸中氯化氢的质量为y,
MgCO3+2HCl═MgCl2+H2O+CO2↑,
84 73 44
x y 6.6g
=
=
,
x=12.6g,y=10.95g,
碳酸镁样品中碳酸镁的质量分数为:
×100%=84%,
答:碳酸镁样品中碳酸镁的质量分数为84%.
(2)参加反应的稀盐酸中溶质的质量分数为:
×100%=10%,
答:参加反应的稀盐酸中溶质的质量分数为10%.
MgCO3+2HCl═MgCl2+H2O+CO2↑,
84 73 44
x y 6.6g
| 84 |
| x |
| 73 |
| y |
| 44 |
| 6.6g |
x=12.6g,y=10.95g,
碳酸镁样品中碳酸镁的质量分数为:
| 12.6g |
| 15g |
答:碳酸镁样品中碳酸镁的质量分数为84%.
(2)参加反应的稀盐酸中溶质的质量分数为:
| 10.95g |
| 115.5g+6.6g-12.6g |
答:参加反应的稀盐酸中溶质的质量分数为10%.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
下列说法正确的是( )
| A、若两微粒属同一种元素,则它们的质子数一定相同 |
| B、若两微粒质子数相同,则它们的一定属同一种元素 |
| C、同种单质必定由同种元素组成 |
| D、同种元素只能组成一种单质 |
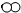 ”和“
”和“ ”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下:
”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下: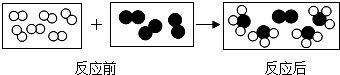
 某化学活动小组为探究银白色金属R和金属锌、铜的金属活动性顺序,分步做如下实验:
某化学活动小组为探究银白色金属R和金属锌、铜的金属活动性顺序,分步做如下实验: