题目内容
 某化学活动小组为探究银白色金属R和金属锌、铜的金属活动性顺序,分步做如下实验:
某化学活动小组为探究银白色金属R和金属锌、铜的金属活动性顺序,分步做如下实验:实验一:在三支试管中分别放入两小块金属R和金属铜、锌,分别加入5mL的稀盐酸,观察现象,发现金属R和锌都能与盐酸反应,并有气泡产生,铜却不能.
由此得出结论
实验二:探讨金属R和锌两种金属的活动性顺序,实验如图:
请在如图横线上填上所需物质.实验结论:锌的金属活动性比金属R强.
若金属R的元素化合为+2价,写出如图实验的化学方程式:
考点:金属活动性顺序及其应用,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:要比较金属的活泼性,主要是利用了金属与酸、与盐溶液的反应来得出结论的.通过Zn、R都与盐酸反应而铜不能和盐酸反应能比较R、Zn、Cu的活动性位于氢前还是氢后,但R与锌的活动性强弱不能证明,因此要加一个实验来证明,可以直接用金属与盐溶液反应,也可通过与酸反应证明.
解答:解:在实验一中,金属R和锌都能与盐酸反应,并有气泡产生,铜却不能,说明锌和R金属活动性位于氢前,而铜位于氢后,因此锌和R金属活动性比铜强;
实验二探讨金属R和锌两种金属的活动性顺序,实验结论:锌的金属活动性比金属R强,根据装置可知是利用金属和盐溶液反应设计实验,因此可以是锌和R的硝酸盐看能否反应,反应则说明锌的活动性比R强;
故答案为:实验一:锌和R金属活动性比铜强;
实验二:(见右图)
R(NO3)2+Zn═Zn(NO3)2+R.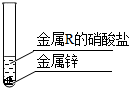
实验二探讨金属R和锌两种金属的活动性顺序,实验结论:锌的金属活动性比金属R强,根据装置可知是利用金属和盐溶液反应设计实验,因此可以是锌和R的硝酸盐看能否反应,反应则说明锌的活动性比R强;
故答案为:实验一:锌和R金属活动性比铜强;
实验二:(见右图)
R(NO3)2+Zn═Zn(NO3)2+R.

点评:本题考查了金属活动性顺序的运用,能够考查学生的实验设计能力,属于能力提高型习题,且本题具有开放性,学生的思维空间较大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
溶洞中形态各异的石笋和钟乳石在形成过程,发生了多个化学反应,其中一个反应的化学方程式为:X+CO2+H2O═Ca(HCO3)2.则X的化学式为( )
| A、CaCO3 |
| B、Ca(OH)2 |
| C、CaO |
| D、Ca |

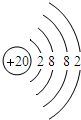 ,钙原子核内质子数为
,钙原子核内质子数为