题目内容
【题目】海水中蕴含含有80多种元素,海洋是一座巨大的宝库.氯碱工业以海水为原材料可以大量制取烧碱和氧气,它们都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于工业生产.所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域.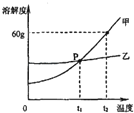
(1)氯碱工业中发生反应的化学方程式为:2NaCl+2H2O═2NaOH+Cl2↑+A,则A的化学式为 . 氯气常用于自来水的杀菌消毒,它与水反应生成盐酸和次氯酸(HClO),试写出该反应的化学方程式 .
(2)如图是甲、乙两种固体物质的溶解度曲线.
①P点的意义是 .
②甲物质中含有少量乙物质,提纯甲物质可用方法(选填“降温结晶”、“蒸发结晶”之一).请简述理由 .
③t2℃时,将100g固体甲与100g水混合后所得溶液的质量分数是 . (精确到0.1%)
【答案】
(1)H2;Cl2+H2O=HCl+HClO
(2)在t1℃,甲乙两物质溶解度相等;降温结晶;甲物质的溶解度随温度升高明显增大,而乙物质溶解度受温度的变化影响小,降温时,甲物质溶解度明显变小,其饱和溶液中会有大量结晶析出,而乙不会;37.5%
【解析】解:(1)根据质量守恒定律和氯碱工业中发生反应的化学方程式为:2NaCl+2H2O=2NaOH+Cl2↑+A,推测A的化学式为H2;根据“氯气常用于自来水的杀菌消毒,它与水反应生成盐酸和次氯酸(HClO)”,则其反应的化学方程式为:Cl2+H2O=HCl+HClO;故填:H2;Cl2+H2O=HCl+HClO;(2)①P点是t1℃时甲、乙两物质的溶解度曲线的交点,表示的意义是在t1℃时,甲、乙两物质的溶解度相等;故填:在t1℃,甲乙两物质溶解度相等;②从溶解度曲线可以看出:甲的溶解度变化受温度影响比乙大,所以甲物质中含有少量乙物质,可采用降温结晶的方法提纯甲物质;故填:降温结晶;甲物质的溶解度随温度升高明显增大,而乙物质溶解度受温度的变化影响小,降温时,甲物质溶解度明显变小,其饱和溶液中会有大量结晶析出,而乙不会;③从溶解度曲线可以看出,t2℃时,甲的溶解度为60g,所以100g水中只能溶解60g,则甲的饱和溶液中溶质的质量分数= ![]() .故填:37.5%.
.故填:37.5%.
【考点精析】解答此题的关键在于理解结晶的原理、方法及其应用的相关知识,掌握结晶的两种方法:蒸发溶剂,如NaCl(海水晒盐)和降低温度(冷却热的饱和溶液,如KNO3),以及对固体溶解度曲线及其作用的理解,了解1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和).

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案【题目】下面的表格中列出了氯化铵在不同温度下的溶解度:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 | 65.6 |
(1)从表中可得到的一条信息是;
(2)20℃时,向50g水中加入20g氯化铵,形成氯化铵的(填“饱和”或“不饱和”)溶液,将其温度升高至60℃时,所得溶液的质量为;
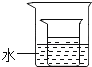
(3)将(2)中所得的60℃时的氯化铵溶液放入如图所示的小烧杯中,在大烧杯的水中加入下列物质,能够使小烧杯中有固体析出的是 (填字母序号);
A.冰
B.氯化钠
C.硝酸铵
D.氧化钙
(4)某同学欲配制20℃时20%的氯化铵溶液500g,需要氯化铵的质量 . 他在量取水时俯视读数,在其他操作都无误的情况下,他配制的溶液的溶质质量分数将(填“偏大”或“偏小”).