题目内容
工业生产的纯碱(Na2CO3)产品中常含杂质(杂质不反应).为测定该产品中碳酸钠的质量分数,现称取6g样品放在烧杯中并滴入稀盐酸.当稀盐酸滴加至36.5g时,恰好完全反应,烧杯内剩余物的总质量为40.3g(假设产生的气体全部逸出).(已知:Na2CO3+2HCl═2NaCl+H2O+CO2↑)
请计算:(1)产生气体的质量为 .
(2)样品中碳酸钠的质量分数 .
请计算:(1)产生气体的质量为
(2)样品中碳酸钠的质量分数
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:根据质量守恒定律结合由烧杯中物质的质量反应前后的变化可得出生成的二氧化碳的质量,然后根据化学方程式即可求出碳酸钠的质量,然后求质量分数.
解答:解:(1)根据质量守恒定律,生成气体的质量为:6g+36.5g-40.3g=2.2g,故生成气体质量为2.2g;
(2)解:设样品中碳酸钠的质量为x,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 2.2g
=
x=5.3g
样品中碳酸钠的质量分数:
×100%=88.3%.
故答案为:(1)2.2g;
(2)88.3%
(2)解:设样品中碳酸钠的质量为x,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 2.2g
| 106 |
| x |
| 44 |
| 2.2g |
x=5.3g
样品中碳酸钠的质量分数:
| 5.3g |
| 6g |
故答案为:(1)2.2g;
(2)88.3%
点评:本题主要考查化学方程式的书写、质量守恒定律和有关化学方程式的计算,只要看清反应前后烧杯中物质减轻是因为生成了气体二氧化碳即可顺利解答;计算是要细心、准确.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
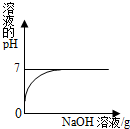
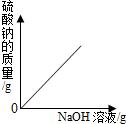
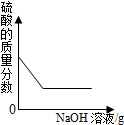
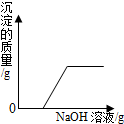
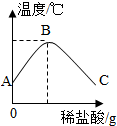 将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出烧杯中溶液的温度,溶液温度随加入稀盐酸的质量而变化如图所示:
将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出烧杯中溶液的温度,溶液温度随加入稀盐酸的质量而变化如图所示: 人体中铁元素主要存在于血液中,是血红蛋白的成分,能帮助氧气的运输.如果体内缺铁会引起贫血.如图是某品牌补铁剂的药品标签.请回答:
人体中铁元素主要存在于血液中,是血红蛋白的成分,能帮助氧气的运输.如果体内缺铁会引起贫血.如图是某品牌补铁剂的药品标签.请回答:
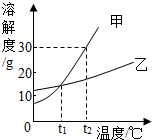 如图是甲、乙两种固体物质的溶解度曲线.
如图是甲、乙两种固体物质的溶解度曲线.