题目内容
【题目】科学探究Ⅰ:某同学用稀盐酸和石灰石(杂质不与稀盐酸反应,也不溶于水)反应制取二氧化碳并验证其性质(如图所示),实验时发现烧杯中澄清石灰水先变浑浊,后逐渐变澄清(提示碳酸钙能与二氧化碳、水发生反应生成碳酸氢钙,碳酸氢钙易溶于水)。
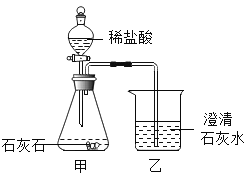
(1)甲装置中发生反应的化学方程式是____。
(2)实验开始时,乙装置中澄清石灰水没有出现浑浊现象,出现这种现象可能的原因是_____。
(3)实验结束时,甲装置溶液中的溶质除氯化钙外,还可能有__(填化学式)。
科学探究Ⅱ:化学实验小组的同学在实验室里发现桌上有瓶敞口放置已久的NaOH溶液,他们对溶质的成分产生了探究的欲望。
(查阅资料)Ca2+和OH-在水溶液中不能大量共存
(提出问题)这瓶NaOH溶液一定变质了,其变质程度如何呢?
(提出猜想)猜想一:NaOH溶液部分变质;猜想二:NaOH溶液完全变质
(实验探究)
(1)氢氧化钠溶液变质的原因为_________(用化学方程式表示)。
(2)小华设计了如下实验进行探究,请根据表中内容填写:
实验步骤 | 现象 | 结论 | |
步骤一 | 取少量NaOH溶液样品于试管中,向其中滴加过量的CaCl2溶液 | 产生白色沉淀 | 猜想____成立 |
步骤二 | 过滤,向滤液中滴加酚酞溶液。 | 酚酞溶液变红 | |
如果步骤一中白色沉淀由两种物质组成,则两种物质是:________(填化学式);步骤二中根据酚酞溶液变红这一现象证明样品中含有____(填字母)。
A CaCl2 B Na2CO3 C NaOH D Na2CO3和NaOH
(实验反思)
(1)下列物质①BaCl2溶液、②Ca(NO3)2溶液,③Ca(OH)2溶液、④Ba(OH)2溶液,不能替代步骤一中CaCl2溶液的是____(填序号)。
(2)步骤二中用另外一种试剂代替酚酞溶液也能得出同样的结论,发生反应的化学方程式_____。
【答案】![]() 二氧化碳气体中混有氯化氢气体 HCl CO2+2NaOH=Na2CO3+H2O 猜想一 CaCO3、Ca(OH)2 C ③④
二氧化碳气体中混有氯化氢气体 HCl CO2+2NaOH=Na2CO3+H2O 猜想一 CaCO3、Ca(OH)2 C ③④ ![]()
【解析】
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,盐酸和氢氧化钙反应生成氯化钙和水,氢氧化钠和二氧化碳反应生成碳酸钠和水,碳酸钠和氯化钙反应生成碳酸钙和氯化钠,硫酸铜和氢氧化钠生成氢氧化铜和硫酸钠。
科学探究Ⅰ:
(1)甲装置中发生反应是碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式是![]() 。
。
(2)浓盐酸具有挥发性,挥发出的氯化氢和氢氧化钙反应生成氯化钙和水,实验开始时,乙装置中澄清石灰水没有出现浑浊现象,出现这种现象可能的原因是二氧化碳气体中混有氯化氢气体。
(3)实验结束时,甲装置溶液中的溶质除氯化钙外,还可能有过量的氯化氢,化学式为HCl。
科学探究Ⅱ:
[实验探究]
(1)氢氧化钠溶液变质的原因是氢氧化钠和二氧化碳反应生成碳酸钠和水,反应的化学方程式为CO2+2NaOH=Na2CO3+H2O。
(2)氢氧化钠溶液显碱性,能使无色酚酞溶液变红色,氢氧化钠和二氧化碳反应生成碳酸钠和水,碳酸钠和氯化钙反应生成碳酸钙和氯化钠。
实验步骤 | 现象 | 结论 | |
步骤一 | 取少量NaOH溶液样品于试管中,向其中滴加过量的CaCl2溶液 | 产生白色沉淀 | 猜想一成立 |
步骤二 | 过滤,向滤液中滴加酚酞溶液。 | 酚酞溶液变红 | |
如果步骤一中白色沉淀由两种物质组成,碳酸钠和氯化钙反应生成碳酸钙和氯化钠,钙离子和氢氧根离子大量共存时生成氢氧化钙,故两种物质是碳酸钙和氢氧化钙,化学式为CaCO3、Ca(OH)2;碱性溶液能使酚酞溶液变红,氢氧化钠显碱性,步骤二中根据酚酞溶液变红这一现象证明样品中含有NaOH,故选C。
[实验反思]
(1)步骤一中滴加过量氯化钙溶液的目的是证明碳酸钠的存在并除尽碳酸钠,防止碳酸钠的存在对氢氧化钠的检验造成干扰,氯化钡和碳酸钠反应生成碳酸钡沉淀和氯化钠,硝酸钙和碳酸钠反应生成碳酸钙沉淀和硝酸钠,氯化钠溶液和硝酸钠溶液都呈中性,可以用氯化钡溶液、硝酸钙溶液代替氯化钙溶液,氢氧化钙和氢氧化钡中都含有氢氧根离子,它们和碳酸钠反应都会生成氢氧化钠,会对原溶液中是否含有氢氧化钠的检验造成干扰,不能用氢氧化钙溶液和氢氧化钡溶液代替氯化钙溶液,故选③④。
(2)步骤二中用硫酸铜代替酚酞溶液也能得出同样的结论,发生反应是硫酸铜和氢氧化钠生成氢氧化铜和硫酸钠,反应的化学方程式为![]() 。
。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案【题目】我国约在南北朝时就开始冶炼黄铜,黄铜是铜和锌的合金(Cu-Zn),它可以用来制造电器零件及日用品。小华利用一瓶稀盐酸和相关的仪器,测定黄铜样品的组成(不考虑铜中的其它杂质)。将30ml稀盐酸分别加入到10g黄铜粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
第一次 | 第二次 | 第三次 | |
连续加入盐酸的体积/mL | 10 | 10 | 10 |
生成氢气的质量/g | 0.08 | 0.08 | 0.04 |
(1)从上表数据分析,小华用10g合金粉末共收集到氢气 g;
(2)求该合金中铜的质量分数。