题目内容
【题目】某氢氧化钠样品中可能混有Na2SO4和Na2CO3杂质,化学实验小组的同学们为了探究该氢氧化钠样品中杂质的成分,并提纯样品,做了如下探究实验:取少 量氢氧化钠样品,加足量水溶解,待用。
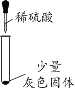
(实验探究1)甲同学:如图所示,取一定量氢氧化钠样品溶液于试管中,向其中加入稀硫酸,观察到溶液中有气泡冒出,再向其中滴加硝酸钡溶液,观察到溶液中有白色沉淀产生
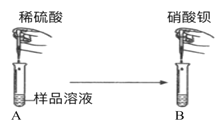
(1)请你写出该过程中,最先发生的化学反应的方程式:___________;
(2)根据实验现象,甲同学得出结论:样品中含有的杂质为碳酸钠和硫酸钠。 请你评价甲同学的实验结论:________。
(提出问题)将B试管中混合物过滤,测得滤液pH>7,则所得滤液中含有哪些离子?
猜想一:Na+、NO3-、OH-、Ba2+
猜想二:Na+、NO3-、OH-、SO42-
猜想三:Na+、NO3-、CO32-
(3)你的猜想是:________ (填离子符号)
(4)上述猜想中一定错误的是________。
(实验探究2)乙同学:另取少量氢氧化钠样品溶液于试管中,向其中先加入________,再加入硝酸钡溶液,观察到_________,则证明样品中含有两种杂质。
(表达与交流)同学们经过讨论后认为,要除去氢氧化钠样品中的杂质,只需要向样品的溶液中加入一种试剂,即_________溶液,充分搅拌后过滤,蒸发结晶即可得到纯净的氢氧化钠固体。
【答案】![]() 不合理,加入硫酸后,硫酸与氢氧化钠和碳酸钠都可以反应生成硫酸钠,硫酸钠可与硝酸钡反应生成碳酸钡沉淀,而硫酸钠不一定是原样品中存在的,也可以是加入硫酸后生成的,另外碳酸钠过量,有剩余的碳酸钠也可与硝酸钡反应生成碳酸钡沉淀,因此不能确定杂质是否含有硫酸钠
不合理,加入硫酸后,硫酸与氢氧化钠和碳酸钠都可以反应生成硫酸钠,硫酸钠可与硝酸钡反应生成碳酸钡沉淀,而硫酸钠不一定是原样品中存在的,也可以是加入硫酸后生成的,另外碳酸钠过量,有剩余的碳酸钠也可与硝酸钡反应生成碳酸钡沉淀,因此不能确定杂质是否含有硫酸钠 ![]() 猜想一、猜想二 足量稀盐酸(稀硝酸) 有气泡产生和白色沉淀生成 氢氧化钡
猜想一、猜想二 足量稀盐酸(稀硝酸) 有气泡产生和白色沉淀生成 氢氧化钡
【解析】
实验探究1:
加入硫酸后,先发生酸碱中和反应,所以是氢氧化钠与硫酸反应生成硫酸钠和水,据此书写化学方程式为![]() ;反应后加入硝酸钡溶液,氢氧化钠与硫酸钠反应生成了硫酸钠,另外有气泡冒出,说明含有碳酸钠,碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,若碳酸钠过量,则硫酸被消耗完毕,生成硫酸钠,还有残留的碳酸钠,都与加入的硝酸钡反应生成硫酸钡沉淀和碳酸钡沉淀,都可以加入白色沉淀,因此无法判断硫酸钠是否存在;
;反应后加入硝酸钡溶液,氢氧化钠与硫酸钠反应生成了硫酸钠,另外有气泡冒出,说明含有碳酸钠,碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,若碳酸钠过量,则硫酸被消耗完毕,生成硫酸钠,还有残留的碳酸钠,都与加入的硝酸钡反应生成硫酸钡沉淀和碳酸钡沉淀,都可以加入白色沉淀,因此无法判断硫酸钠是否存在;
故填:![]() ;不合理,加入硫酸后,硫酸与氢氧化钠和碳酸钠都可以反应生成硫酸钠,硫酸钠可与硝酸钡反应生成碳酸钡沉淀,而硫酸钠不一定是原样品中存在的,也可以是加入硫酸后生成的,另外碳酸钠过量,有剩余的碳酸钠也可与硝酸钡反应生成碳酸钡沉淀,因此不能确定杂质是否含有硫酸钠。
;不合理,加入硫酸后,硫酸与氢氧化钠和碳酸钠都可以反应生成硫酸钠,硫酸钠可与硝酸钡反应生成碳酸钡沉淀,而硫酸钠不一定是原样品中存在的,也可以是加入硫酸后生成的,另外碳酸钠过量,有剩余的碳酸钠也可与硝酸钡反应生成碳酸钡沉淀,因此不能确定杂质是否含有硫酸钠。
提出问题:
加入硫酸产生了气泡,说明氢氧化钠全部反应完毕,溶液中不存在氢氧根离子,若硫酸不足,则碳酸钠会有剩余,加入硝酸钡不足以将硫酸根与碳酸根全部转化为沉淀,那此时溶质有硫酸钠、碳酸钠、硝酸钠,此时离子为钠离子、硝酸根离子、硫酸根离子和碳酸根离子;根据实现现象可知,当有气泡产生时,氢氧化钠已经全部反应完毕,所以氢氧根不会有残留,因此猜想一和猜想二一定不成立;
故填:![]() ;猜想一、猜想二。
;猜想一、猜想二。
实验探究2:加入稀盐酸将所有的此时不会引入硫酸根,同时加入足量稀盐酸(或稀硝酸),可以将碳酸钠全部反应完毕,生成了二氧化碳气体,有气泡产生,即证明了碳酸钠的存在又将碳酸钠全部消耗完毕,再加入硝酸钡产生沉淀,则是硫酸钠与硝酸钡生成了硫酸钡沉淀,证明了硫酸钠的存在;
故填:足量稀盐酸;有气泡产生和白色沉淀生成。
表达与交流:
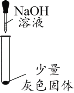
硫酸钠与碳酸钠都与氢氧化钡反应生成硫酸钡、碳酸钡沉淀,剩余溶质为氢氧化钠,不引入其他新的杂质,因此可以加入适量的氢氧化钡,得到溶质只有氢氧化钠,制得纯净的氢氧化钠固体;
故填:氢氧化钡。

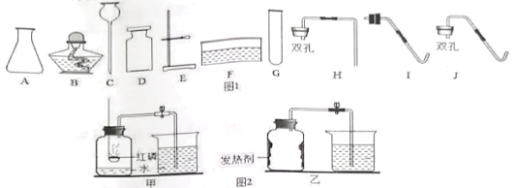
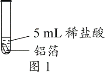
【题目】化学小组同学用图1装置探究铝与盐酸的反应。将未去除表面氧化膜的铝箔放入稀盐酸中,刚开始反应现象不明显,一段时间后反应比较剧烈,产生大量气泡,出现灰色沉淀。
(查阅资料)
①铝粉在颗粒较小时为灰黑色;铝既能与酸反应,又能与碱反应,且反应均生成氢气。
②氯化铝固体为白色颗粒或粉末,易溶于水和乙醇。
③氧化铝与盐酸反应的化学方程式为:![]() 。
。
(实验一)探究灰色固体的成分
实验序号 | 1-1 | 1-2 | 1-3 | 1-4 |
实验操作 |
|
|
|
|
实验现象 | 有微量气泡产生,固体溶解 | 有少量气泡产生,固体溶解 | ____________ | 固体部分溶解 |
(实验二)探究盐酸浓度对灰色固体产生量的影响
取0.09 g铝箔和5 mL不同浓度的稀盐酸,用图1装置进行实验。
实验序号 | 盐酸浓度 | 实验现象 |
2-1 | 4.0% | 刚开始反应现象不明显,一段时间后缓慢反应,然后反应比较剧烈,有大量气泡产生,出现灰色沉淀 |
2-2 | 2.8% | 先是看不到反应现象,一段时间后缓慢反应,然后慢慢地反应比较剧烈,有大量气泡产生,出现少量灰色沉淀 |
2-3 | 2.1% | 3~4小时后明显有气泡产生,反应慢慢地比较快些,试管底部出现少量灰色沉淀 |
2-4 | 1.4% | 反应更慢,出现极少量的灰色沉淀 |
(解释与结论)
(1)铝与盐酸反应的化学方程式为___________。
(2)图1所示实验中,刚开始反应现象不明显,一段时间后才看到有气泡产生的原因是________。
(3)由实验________(填实验序号)可以判断灰色固体中含有铝。
(4)由实验1-4可知,灰色固体中还含有氯化铝。实验1-3的现象是_________。
(5)实验二的结论是__________。
(反思与交流)
(6)为了进一步探究灰色沉淀的出现是否与盐酸中的Cl-有关,可以将稀盐酸换成______进行图1所示实验。
【题目】小芳对复分解反应发生的条件产生兴趣,于是她和小组内同学仅用以下药品展开了探究。
实验药品:稀硫酸、稀盐酸、氢氧化钠溶液、碳酸钠溶液、硝酸钡溶液、氯化钠溶液、酚酞试液
(提出问题)复分解反应发生的条件是什么?
(查阅资料)硝酸钡溶液显中性,且Ba2+有毒。
(实验探究)小芳用上述物质做了下列几组实验
组合序号 | (1) | (2) | (3) | (4) | (5) | (6) |
组合物质 | 稀盐酸 氯化钠 | 稀盐酸 氢氧化钠 | 稀盐酸 碳酸钠 | 稀硫酸 硝酸钡 | 氯化钠 硝酸钡 | 硝酸钡 碳酸钠 |
(记录和解释)
(1)组合(1)、(2)、(5)均无明显现象,其中组合___________与另外两组的实质不同。为证明该不同之处,小芳在实验过程中使用了酚酞试液。
(2)请写出组合(6)的化学方程式___________。
(实验结论)他们通过实验探究并请教老师后知道,只有当两种化合物互相交换成分,生成物中有___________生成时,复分解反应才可以发生。
(拓展延伸)实验结束后,他们将所有废液收集在废液缸中静置,观察到白色沉淀和无色的上层清液。为了确定沉淀和清液的成分,继续展开探究。
(实验1)探究沉淀的成分。
(提出猜想)I.沉淀只有硫酸钡 II.___________, III.沉淀中含有硫酸钡和碳酸钡
小莲取少量沉淀于试管中,滴加过量的___________(请补充完整实验操作和观察到的现象),证明了猜想III是正确的。
(实验2)探究清液的成分。
①取少量清液于试管中,向其中滴加硝酸钡溶液,无明显现象。
②另取少量清液于另一只试管中,滴加___________,有白色沉淀产生。
(解释与结论)探究活动结束后,小组内成员通过讨论分析,一致认为清液中一定没有的离子是___________(指示剂除外,且不考虑水的电离)。
(处理废液)为了防止污染环境,小芳对废液进行处理,将固体回收进一步处理,溶液排放。
(交流与反思)根据你对复分解反应发生条件的了解,请写出一个题中实验药品间除(1)~(6)组合之外,能发生复分解反应的化学方程式___________。