题目内容
【题目】3.0g某物质完全燃烧后生成4.4gCO2和1.8g水.则对该物质相关判断正确的是( )
A.该物质只含碳、氢元素
B.该物质一定含有碳、氢元素,可能含有氧元素
C.该物质一定由碳、氢、氧三种元素组成
D.该物质分子中碳原子和氢原子的个数比为1:2
【答案】CD
【解析】
考点: | 质量守恒定律及其应用.. |
专题: | 化学用语和质量守恒定律. |
根据质量守恒定律,由生成物可以初步确定该物质中含有氢元素和碳元素,由生成的二氧化碳和水中碳、氢元素的质量和与该物质的质量进行对比,从而确定该物质的组成元素.化合物原子的个数比= | |
解答: | 解:4.4gCO2中含有碳元素的质量为:4.4g× A、由上述分析可知,该物质中一定含有碳、氢、氧三种元素,故选项说法错误. B、由上述分析可知,该物质中一定含有碳、氢、氧三种元素,故选项说法错误. C、由上述分析可知,该物质中一定含有碳、氢、氧三种元素,故选项说法正确. D、根据化合物原子的个数比= 故选:CD. |
点评: | 本题难度稍大,主要考查了质量守恒定律、化学式的计算,解题的关键是根据质量守恒定律确定物质的元素组成. |

 阅读快车系列答案
阅读快车系列答案【题目】请从A~D中任选三个作答,若均作答,按前三个给分。
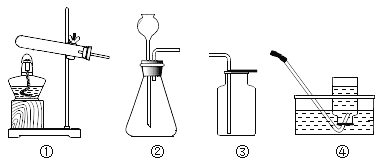
序号 | 目的 | 操作 | 现象 | 结论 |
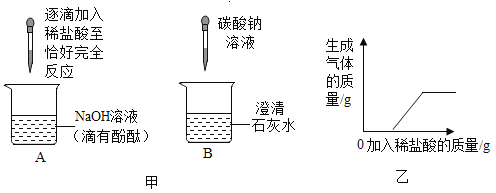
A | 鉴别氯化钠和碳酸钠 |
| 试管1中无明显现象, 试管2中产生气泡 | 试管1中固体为氯化钠,试管2中固体为碳酸钠 |
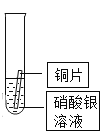
B | 比较铜、银的金属活动性 |
| _______ | 铜的金属活动性比银强 |
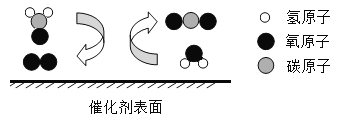
C | 探究水的组成 |
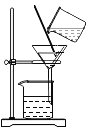
| 正极产生气体能使带火星木条复燃,负极产生气体能燃烧,发出淡蓝色火焰 | _______ |
D | ______ |
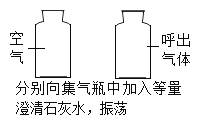
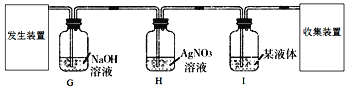
| 左侧集气瓶中溶液无明显变化,右侧集气瓶中溶液变浑浊 | 呼出气体中二氧化碳含量高于空气 |
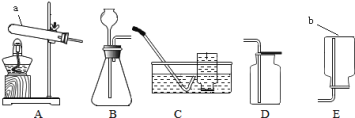
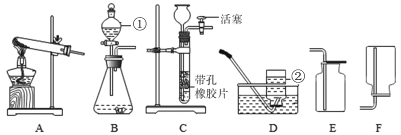
【题目】请从A或B中任选一个作答,若均作答,按A计分。
A | B |
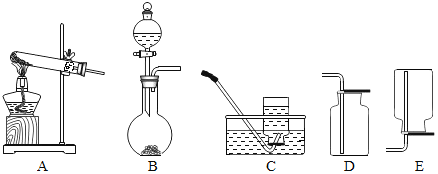
(1)用装置①制氧气,反应的化学方程式为_____。 (2)用装置③收集氧气的原因为______。 | (1)用装置②制二氧化碳,反应的化学方程式为_____。 (2)不用装置④收集二氧化碳的原因为______。 |
| |