题目内容
【题目】质量守恒定律的发现对化学的发展做出了重要贡献。
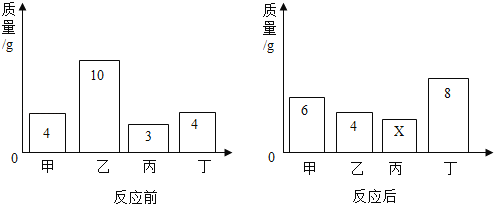
(1)通过称量下列各组试剂在密闭容器内混合前后的总质量,能验证质量守恒定律的是____ (填标号)。
A.蔗糖和水
B.氯化钠溶液和硝酸钾溶液
C.铁和氯化铜溶液
(2)在氧气中点燃红磷的实验过程,固体变化如图1所示。
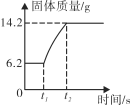
图1
①该反应的化学方程式为_______________
②参加反应的氧气质量为____g。
(3)某反应的微观示意图如图2所示:
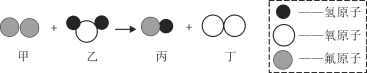
图2
①该反应的化学方程式为_______________。
②参加反应的甲物质和生成的丙物质分子数目比为____。
(4)实验室加热氯酸钾和二氧化锰的混合物28 g制取氧气,完全反应后剩余固体质量为18.4 g,请计算:
①生成氧气的质量________;
②原混合物中氯酸钾的质量_____________。
【答案】C4P+5O2![]() 2P2O58.02F2+2H2O=4HF+O21∶29.6 g,24.5 g
2P2O58.02F2+2H2O=4HF+O21∶29.6 g,24.5 g
【解析】
(1)A、蔗糖和水是溶解过程,是物理变化,不能直接用于验证质量守恒定律;B、氯化钠溶液和硝酸钾溶液不反应,不能直接用于验证质量守恒定律;C、铁和氯化铜溶液,铁比铜活泼,可以将铜置换出来,是化学变化,能直接用于验证质量守恒定律;
(2)①红磷在氧气中燃烧生成五氧化二磷,反应的化学方程式为:4P+5O2![]() 2P2O5;
2P2O5;
②从图示看出,6.2g表示反应前固体的质量,就是红磷的质量,14.2g表示反应后固体的质量,是五氧化二磷的质量,则14.2g-6.2g=8g就表示参加反应的氧气的质量;
(3)①由物质的微观构成可知,该反应的化学方程式为:2F2+H2O=4HF+O2;
②参加反应的甲物质和生成的丙物质分子数目比为2:4=1:2;
(4)生成氧气的质量为:28g-18.4g=9.6g;设参加反应的氯酸钾的质量为x,
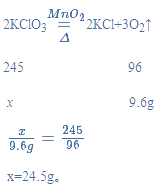

【题目】某校实验小组的同学用木炭与氧化铜反应,证明木炭具有还原性.实验装置图如下:
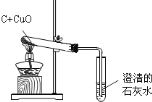
请填写实验报告.
(1)实验用品:
仪器:________.
药品:木炭、氧化铜、澄清石灰水
(2)
现象 | 分析 |
_______ | _______ |
_______ | _______ |
(3)结论
结论:________,反应的化学方程式为:________.
(4)问题和分析
问题:在加热一段时间后,装有木炭和氧化铜试管口部,凝聚了少量的水.但是反应物中并没有氢元素,为什么会有水产生呢?我的________________.
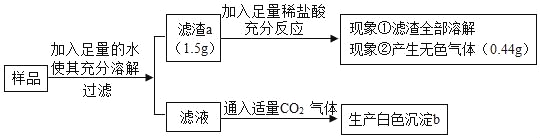
【题目】某化学兴趣小组学习碱的性质后,到实验室做实验.小明将二氧化碳通入氢氧化钠溶液后无明显现象,然后向得到的溶液中滴加CaCl2溶液,产生白色沉淀;小杰做的实验和小明一样,但没有出现白色沉淀.他们为了查明原因,查阅资料:①CO2与NaOH反应的产物与反应物的量有关,少量CO2得到Na2CO3,过量CO2得到NaHCO3,反应的化学方程式:CO2+2NaOH=Na2CO3+H2O,Na2CO3+CO2+H2O=2NaHCO3;②Ca(HCO3)2溶于水,溶液呈碱性;③CaCl2溶液呈中性:④Na2CO3、NaHCO3溶液都呈碱性,都能与酸反应;⑤铝、锌、铁、铜的盐溶液与NaHCO3溶液混合会产生沉淀.
他们对CO2与NaOH溶液反应后,溶液中溶质是什么进行探究.
【猜想与假设】猜想①Na2CO3; 猜想②NaHCO3;
猜想③Na2CO3、NaOH; 猜想④_____________________.
【实验探究】
实验操作 | 实验现象 | 结论 |
(1)取适量反应后的溶液于试管中,加入适量的CaCl2溶液,振荡;再加入____. | 无明显现象;有气泡产生. | 猜想②成立,反应的化学方程式__________. |
(2)取适量反应后的溶液于试管中,加入过量的CaCl2溶液,振荡;过滤,取滤液于另一支试管中,滴加_________. | 产生白色沉淀;______. | 猜想③成立 |
【继续探究】将4.0gNaOH固体溶解在100mL水中,然后通入4.0g二氧化碳气体,充分反应后,所得溶液的溶质是___________.