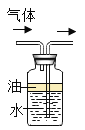
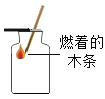
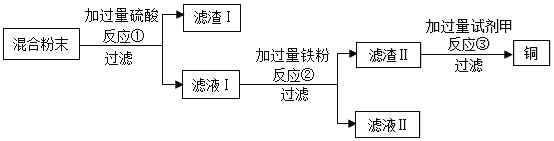
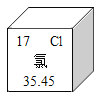
题目内容
【题目】在化学实验技能考试做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质)。为避免污染环境并回收利用废液,化学兴趣小组做了如下实验:取废液桶上层清液共11.88kg,向其中加入溶质质量分数为21.2%的碳酸钠溶液。所得溶液pH 与加入的碳酸钠溶液的质量关系如下图所示:
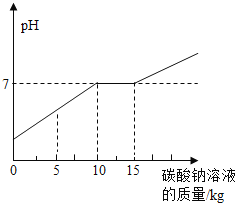
(1)通过下图可知当碳酸钠溶液质量加到_________千克时,废液恰好处理完(盐酸与氯化钙的混合溶液完全转化成氯化钠溶液)。
(2)求此时沉淀的质量______(写出计算过程)
(3)此时所得溶液_________(填“能”或“不能”)用于该校生物兴趣小组的小麦选种液。(选种液要求氯化钠的溶质质量分数在 10%-20%之间)。
【答案】15 1kg 能
【解析】
(1)向大量的盐酸与氯化钙的混合溶液中加入碳酸钠溶液,碳酸钠先与盐酸反应生成氯化钠、水和二氧化碳,由于盐酸显酸性,生成的氯化钠显中性,故反应过程中pH逐渐增大至等于7。继续加入碳酸钠,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,氯化钙和氯化钠均显中性,pH值不变,氯化钙反应完之后,继续滴加碳酸钠,pH增大。故分析图示可知当碳酸钠溶液质量加到15千克时,废液恰好处理完。
(2)由图象可知与溶液中氯化钙反应的碳酸钠溶液的质量为:15kg-10kg=5kg,所含碳酸钠的质量是5kg×21.2%=1.06kg,设生成碳酸钙沉淀的质量为x,生成氯化钠的质量为y,
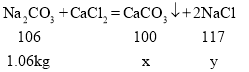
![]()
x=1kg,y=1.17kg
(3)根据图示可知,与盐酸反应的碳酸钠质量为:10kg×21.1%=2.12kg,设碳酸钠与稀盐酸反应生成氯化钠的质量为z,生成二氧化碳的质量为m,
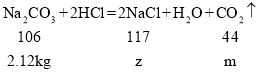
![]()
z=2.34kg,m=0.88kg
废液恰好处理完时溶液中氯化钠的质量分数为:![]()
14.04%介于10%-20%之间,能用于该校生物兴趣小组的小麦选种液。

 名校课堂系列答案
名校课堂系列答案【题目】马英同学取某地石灰石样品12 g进行测定实验,现将100 g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如下表所示。试求:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 1.1 | 2.2 | m | 4.4 | 4.4 |
(1)m的值为_____g。
(2)12 g石灰石样品中碳酸钙的质量为____g。
(3)反应完全后最终溶液中氯化钙的质量分数?(写出计算过程,计算结果精确至0.1%)________
【题目】20℃时,在盛有 100g 水的烧杯中加入 70g 硝酸钾,充分溶解后,逐渐升温(不 考虑水蒸发的影响),测定不同温度时剩余固体质量。测定结果记录如下表:
溶液温度/℃ | 20 | 30 | 40 | 50 | 60 |
剩余固体质量/g | 38.4 | 24.2 | 6.1 | 0 | 0 |
(1)20℃时,硝酸钾的溶解度为_____。
(2)30℃时,所得溶液是硝酸钾的_____(填“饱和”或“不饱和”)溶液,该溶液中硝酸钾 的质量分数为_____(结果保留到 0.1%)
(3)温度从 50℃升高到 60℃过程中,溶液中硝酸钾的质量分数_____(填字母)。
A 变大 B 变小 C 不变 D 无法判断
(4)将 60℃时接近饱和的硝酸钾溶液变成饱和溶液,下列方法能达到目的有_____(填字母)。
a 升温 b 降温 c 加适量硝酸钾 d 加适量水 e 恒温蒸发水
(5)某同学要配制 50g 溶质质量分数为 15%的硝酸钾溶液,实验时发现硝酸钾已结块,为 了较快地溶解,合理的方法有_____(填字母)。
A将硝酸钾研碎 B 用热水溶解 C 多加一些水 D 用玻璃棒搅拌
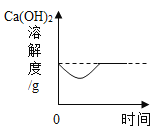
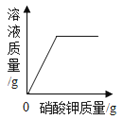
【题目】如图所示图像中,能正确反映对应变化关系的是
A | B | C | D |
|
|
|
|
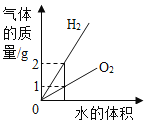
向饱和石灰水中加入一定量CaO | 一定温下,向不饱和硝酸钾溶液中加入硝酸钾固体 | 一定质量的红磷在密闭容器内燃烧 | 电解水生成氢气和氧气质量 |
A. A B. B C. C D. D