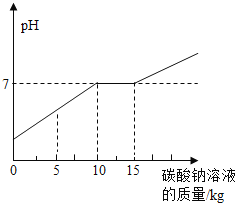
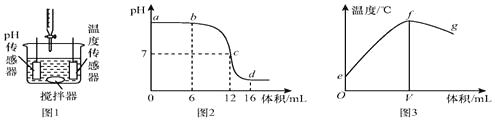
��Ŀ����
����Ŀ��ľ̿��ԭ����ͭʵ���Ļ�Ϸ�ĩ�к���ͭ������ͭ��ľ̿�ۣ�ij��ѧС��ͬѧ��ƻ���ͭ�ķ������£�
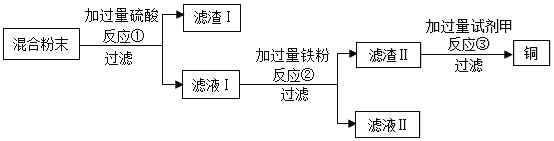
����ʾ��ľ̿����ϡ���ᷴӦ��
��1�����˲����б����õ��IJ��������У��ձ�����������_____________��
��2����Ӧ�ٵĻ�ѧ����ʽΪ___________________________________��
��3����Ӧ������________��Ӧ����д������Ӧ���ͣ�����ҺII�е�����Ϊ______����д��ѧʽ����
��4���Լ�����ѡ��������Һ�е�_____________������ţ���
�� H2SO4 �� CuSO4 �� ZnSO4
��5�������������з������϶����е�������_________________��Ϊ������ʵ�鷽�����ɶ��������е�________���л��ա�
���𰸡�©�� ![]() �û�
�û� ![]() �٢� ͭ��ľ̿�� ͭ
�٢� ͭ��ľ̿�� ͭ
��������
����ͭ�����ᷴӦ��������ͭ��ˮ��ͭ��ľ̿�������Ӧ����������ͭ����ͭ������������
��1�����˲����б����õ��IJ��������У��ձ�����������©����
��2��ͭ��ľ̿�������Ӧ����Ӧ��������ͭ�����ᷴӦ��������ͭ��ˮ����Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
��3����Ӧ�ٺ���Һ���е������ǹ��������������ͭ�����˺����Һ�м���������ۣ������ķ�Ӧ�������������Ӧ������������������������ͭ������Ӧ��������������ͭ��������һ�ֵ��ʺ�һ�ֻ�����������һ�ֵ��ʺ���һ�ֻ�����������û���Ӧ����Ӧ����ҺII�е�����Ϊ������������ѧʽΪ![]() ��
��
��4���������к���ͭ���������ۣ������ۺ�õ�ͭ����֪�dz�ȥ���������ۣ����������ͭ��Һ������������Ӧ��ȥ�������������Լ����������������ͭ��Һ����ѡ�٢ڡ�
��5����Ӧ��������ͭ�����ᷴӦ��������ͭ��ˮ��ͭ��ľ̿�������Ӧ�����˺��Ϸ�ĩ�е�ͭ��ľ̿��û�к��ᷴӦ�������������У��������п϶�����ͭ��ľ̿�ۣ�Ϊ�˻��ո����ͭ���ɽ��������е�ͭҲ���ա�