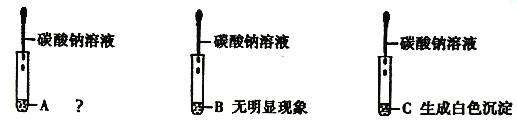
题目内容
【题目】由CaCO3、Fe Cl3、Na2SO4、NaOH、NaCl、BaCl2中的几种组成的粉末.为确定其组成,进行以下实验:
①取粉末样品加水搅拌后过滤,得到沉淀和无色溶液A。
②向上述沉淀中加入足量稀盐酸,得到黄色溶液且无气泡产生。
③取无色溶液A进行如图所示的实验.
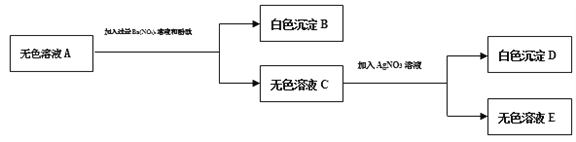
Ⅰ.D的化学式是_______。
Ⅱ.无色溶液A中一定有的溶质是__________。
Ⅲ.生成白色沉淀B的化学方程式是___________________。
Ⅳ.这包粉末中一定不含有的物质是_____________ ,可能含有的物质是 __________。
【答案】 AgCl Na2 SO4和 NaCl Na2 SO4 + Ba(NO3)2 → BaSO4↓+2 NaNO3 CaCO3 NaCl
【解析】①取一定质量的粉末,加水搅拌后过滤,得到沉淀和无色溶液A,沉淀可能有碳酸钙,也可能有氢氧化铁沉淀;②向①步得到的沉淀中加入足量稀盐酸,得到无色气体和黄色溶液,所以沉淀中一定含有碳酸钙和氢氧化铁,原混合物中一定含有碳酸钙、氢氧化钠、氯化铁;无色溶液A中加入硝酸钡会生成白色沉淀,所以A中一定含有硫酸钠,硫酸钠和氯化钡不能共存,一定不含氯化钡,C中加入硝酸银会生成白色沉淀,所以混合物中一定含有氯离子,氯化铁会提供氯离子,混合物中可能含有氯化钠,D是氯化银沉淀,所以
Ⅰ.D的化学式是AgCl;
Ⅱ.无色溶液A中一定有的溶质是:Na2SO4、NaCl;
Ⅲ.生成白色沉淀B的反应是硫酸钠和硝酸钡反应生成硫酸钡沉淀和硝酸钠,化学方程式是:Na2SO4 + Ba(NO3)2 → BaSO4↓+2NaNO3;
Ⅳ这包粉末中一定不含有的物质是BaCl2,可能含有的物质是NaCl。

练习册系列答案
相关题目