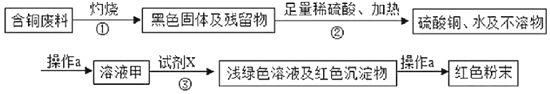
题目内容
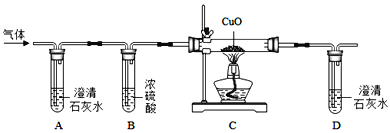
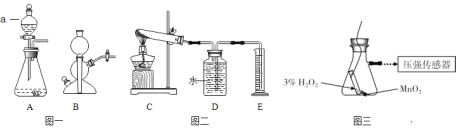
【题目】实验室常用的气体发生装置如图一所示。
(1)仪器a的名称___;
(2)含溶质6.8g的过氧化氢溶液完全分解,可以生成___克氧气;
(3)用5%的过氧化氢溶液和二氧化锰为原料制取氧气,较合理的发生装置是______(选填装置编号);
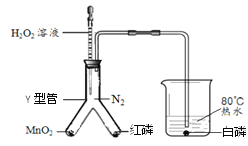
(4)加热氯酸钾和二氧化锰的混合物一段时间,测定生成氧气的体积,用图二所示装置进行实验(装置气密性良好)。试管中发生反应的化学方程式是__;有关该实验的说法合理的是__(选填编号);
a.实验开始前装置D中必须装满水
b.先连接C、D、E装置后点燃酒精灯
c.停止加热后,量筒内液面会下降
d.停止加热前应断开C、D 装置,防止液体倒流
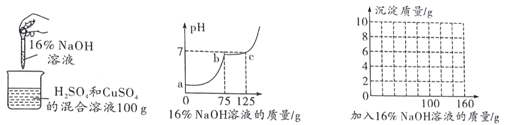
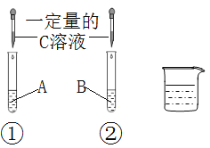
(5)某老师设计图三装置探究二氧化锰的质量对过氧化氢溶液分解反应的影响。
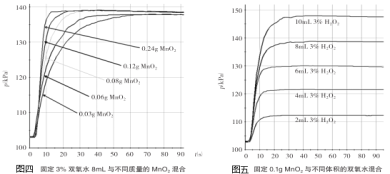
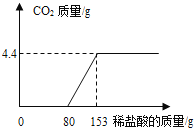
探究Ⅰ.每次固定取用双氧水溶液(3%)8mL分别与不同质量的二氧化锰混合,记录容器内压强的变化于图四中。当二氧化锰的用量增加到0.08g后,曲线的斜率(即表征催化反应的速率)基本上就一致了。因此能快速催化的二氧化锰的最小用量与过氧化氢的质量比约为___(双氧水溶液的密度近似为1g/mL),二氧化锰的质量很小时,反应速率慢的原因是___。
探究Ⅱ.每次固定取用0.1g二氧化锰分别和不同体积的3%的双氧水溶液混合,记录容器内压强的变化于图五中,当双氧水溶液的体积由2mL增加到___mL时,与探究Ⅰ中反应速率相近。该实验说明生成氧气的质量与___的质量成正比。
【答案】分液漏斗 3.2 A 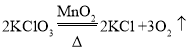 abcd 1:3 接触面积小 10 过氧化氢
abcd 1:3 接触面积小 10 过氧化氢
【解析】
过氧化氢在二氧化锰催化作用下生成水和氧气,氯酸钾和二氧化锰加热生成氯化钾和氧气。
(1)仪器a的名称分液漏斗。
(2)设含溶质6.8g的过氧化氢溶液完全分解,可以生成氧气的质量为x
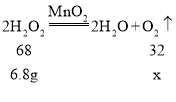
![]()
![]()
故含溶质6.8g的过氧化氢溶液完全分解,可以生成氧气的质量为3.2g。
(3)用5%的过氧化氢溶液和二氧化锰为原料制取氧气,是固液不加热装置,合理的发生装置是A。
(4)加热氯酸钾和二氧化锰的混合物一段时间,测定生成氧气的体积,用图二所示装置进行实验(装置气密性良好)。试管中发生反应是氯酸钾和二氧化锰加热生成氯化钾和氧气,化学方程式是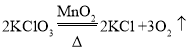 。
。
a、用排水法收集气体,集气瓶必须装满水,则实验开始前装置D中必须装满水,故a正确;
b.连接好C、D、E装置后点燃酒精灯,故b正确;
c.停止加热后,集气瓶压强变小,水会倒吸,则量筒内液面会下降,故c正确;
d.停止加热前应断开C、D 装置,防止液体倒流,故d正确。故选abcd。
(5)探究Ⅰ.每次固定取用双氧水溶液(3%)8mL分别与不同质量的二氧化锰混合,记录容器内压强的变化于图四中。当二氧化锰的用量增加到0.08g后,曲线的斜率(即表征催化反应的速率)基本上就一致了。因此能快速催化的二氧化锰的最小用量与过氧化氢的质量比约为1:3 (双氧水溶液的密度近似为1g/mL),二氧化锰的质量很小时,反应速率慢的原因是接触面积小。
探究Ⅱ.每次固定取用0.1g二氧化锰分别和不同体积的3%的双氧水溶液混合,记录容器内压强的变化于图五中,当双氧水溶液的体积由2mL增加到10mL时,与探究Ⅰ中反应速率相近。实验说明生成氧气的质量与过氧化氢的质量成正比。

【题目】化学学科实践活动课上,老师拿来一包粉末。它是由长期放置在空气中的铁粉和久置的碱石灰干燥剂混合而成,让同学们设计实验进行探究。
(提出问题)固体样品的成分是什么?
(查阅资料)(1)碱石灰干燥剂是CaO和NaOH的混合物。(2)CaCl2溶液显中性。
(猜想与假设)固体样品中可能含有 Fe、Fe2O3、CaO、NaOH、Ca(OH)2、Na2CO3和_____等七种物质。
(进行实验)
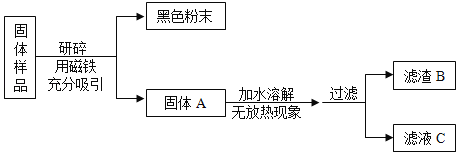
甲组同学对滤渣B的成分进行探究,记录如下:
实验操作 | 实验现象 | 实验结论及化学方程式 |
取少量滤渣B于试管中,加入足量稀盐酸,将生成的气体通入澄清的石灰水中 | ①_______________ ②_______________ | 结论:滤渣B中有 Fe2O3,CaCO3。 实验操作中Fe2O3与稀盐酸反应的化学方程式为:____________________ |
乙组同学对滤液C的成分进行探究,记录如下:
实验操作 | 实验现象 | 实验结论及化学方程式 |
取少量滤液C于试管中,加入过量CaCl2溶液,静置,向上层清液中滴加无色酚酞试液,振荡 | ①有白色沉淀生成 ②酚酞试液由无色变成红色 | 滤液C中有__________; 滤液C中的物质与CaCl2反应的化学方程式是_________________ |
(解释与结论)(1)乙组同学实验中加入过量CaCl2溶液的目的是________________________
(2)通过以上实验探究,该固体样品中能确定一定含有的成分是___________________。