题目内容
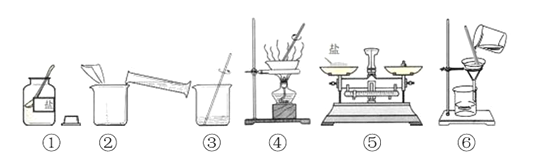
【题目】(共20分)工业上常用分离液态空气法制取氧气,实验室常用物质分解的方法制氧气。某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从下图中选择装置进行了氧气的制备实验。
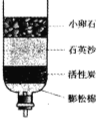
(1)(2分)工业制氧气是 (填“物理”或“化学”)变化,仪器a的名称是: 。
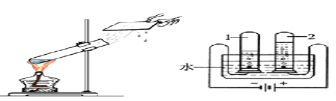
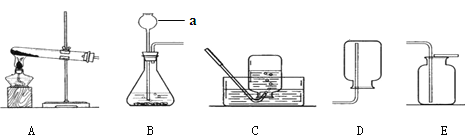
(2)(4分)甲同学从上图中选择B、E装置的组合制取氧气,反应的符号表达为: 。反应类型为( )收集氧气还可选用的装置是 。
(3)(3分)若用装置B制氧气,反应通常很剧烈,据此提出实验安全注意事项是
A.更换部分仪器,控制液体的加入速度
B.用体积小的广口瓶
C.加热反应物
D.减小过氧化氢浓度
(4)(2分)氨气极易溶于水,且密度比空气小,实验室常用加热固体硫酸铵和固体熟石灰的混合物来制取氨气,应选用上图 作发生装置,收集氨气最好用上图 装置。
(5)(4分)乙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2.实验结束时,乙同学发现收集到的O2大于理论产量.针对这一现象,同学们进行了如下探究:
【提出猜想】猜想Ⅰ:反应生成的MnO2分解放出O2;
猜想Ⅱ:反应生成的K2MnO4分解放出O2;
猜想Ⅲ:反应生成的K2MnO4和MnO2分解放出O2.
【实验验证】同学们分成两组,分别进行下列实验:第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜测 错误;第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论.该组同学选择的实验方法是 。
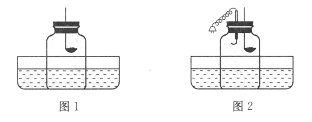
(6)(5分)丙同学阅读课外资料得知:双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是他对氧化铜产生了探究兴趣,请你一起参与实验探究,并填写下列空白:。
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】丙同学以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)。
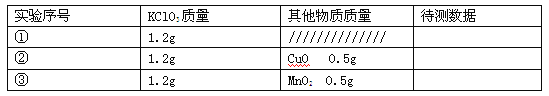
(Ⅰ)上述实验应测量的“待测数据”是 。
(Ⅱ)若实验②比实验①的“待测数据”更 (填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率。
(Ⅲ)将实验②反应后的固体加水溶解、过滤、洗涤、干燥,若测量得到0.5g氧化铜( CuO )粉末,再将黑色粉末放入试管中, 。(简述操作和现象)
【预期结论】氧化铜还能作氯酸钾分解的催化剂。
【评价设计】你认为丙同学设计实验③和实验②对比的目的是 。
【答案】(1)“物理” 长颈漏斗
(2)H2O2 MnO2![]() H2O+ O2 分解反应 C
H2O+ O2 分解反应 C
(3)AD
(4)A D
(5)I 把带火星的木条伸入试管中,木条复燃。
(6)(Ⅰ)生成等体积O2.所需的时间 (Ⅱ)小
(Ⅲ)加入过氧化氢溶液,有大量气泡产生。(或其他合理答案)
设计评价:探究氧化铜是否比二氧化锰催化效果好。
【解析】
试题分析:(2)B装置属固液在常温下的反应,故选用的是用过氧化氢溶液制取氧气;E装置属向上排空气法收集氧气;氧气难溶于水,还可用排水法收集;
(3)用过氧化氢溶液制取氧气,若反应速率过快,可降低过氧化氢溶液的浓度或减慢滴加过氧化氢溶液的速率;
(4)用加热固体硫酸铵和固体熟石灰的混合物来制取氨气,根据反应物的状态,属固固加热型,选A装置;氨气的密度比空气小,易溶于水,故只能用向下排空气法收集;
(5)在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,说明二氧化锰没有分解产生氧气,猜想1错误;氧气可用带火星的小木条检验,若产生氧气,则带火星的小木条会复燃;
(6)若氧化铜能做催化剂,则能加快氯酸钾的分解速率,那么可比较收集等体积的氧气所需的时间;判断一种物质是否是某反应的催化剂,要看它是否具备催化剂的特征,即“一变二不变”: 能否改变反应的速率;反应前后本身的质量,是否改变;本身的化学性质是否改变。故还要看氧化铜的质量在化学反应前后是否发生改变;实验③和实验②对比的目的是探究氧化铜是否比二氧化锰催化效果好。