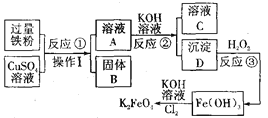
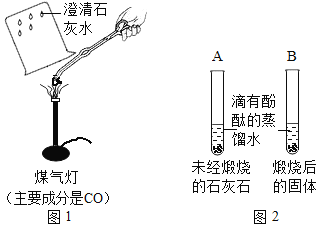
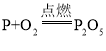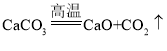题目内容
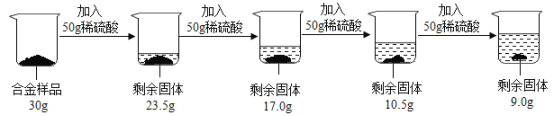
【题目】某合金可能由铜与镁、锌中的一种组成,现欲测定其组成,进行如下实验:取该合金样品30g放入烧杯中,让后将200g溶质质量分数为![]() 的稀硫酸平均分四次依次加入该烧杯中,每次均充分反应。实验数据如下:
的稀硫酸平均分四次依次加入该烧杯中,每次均充分反应。实验数据如下:
请回答下列问题:
(1)写出合金中金属(用R表示)与酸反应的化学方程式_____;
(2)根据已知条件列出求解第二次产生氢气质量(x)的比例式_____;
(3)该合金中铜的质量分数为_____;
(4)若向第三次加入稀硫酸充分反应后的溶液中加入24.3g水,所得不饱和溶液中溶质的质量分数_____;
(5)欲将上述合金样品中的铜转化为铜盐,可将上述最终混合物过滤,将滤渣、洗涤、烘干,然后在空气中加热,充分反应,可得到氧化铜的质量为_____,再经过某些反应就制得铜盐。
【答案】![]()
![]()
![]()
![]()
![]()
【解析】
![]() 铜与镁、锌中,镁、锌活动性位于氢前,能与酸反应生成氢气,并且都显
铜与镁、锌中,镁、锌活动性位于氢前,能与酸反应生成氢气,并且都显![]() 价,金属
价,金属![]() 用R表示
用R表示![]() 与酸反应的化学方程式为:
与酸反应的化学方程式为:![]() ;
;
![]() 金属和50g稀硫酸恰好完全反应,其中硫酸的质量为:
金属和50g稀硫酸恰好完全反应,其中硫酸的质量为:![]() ,
,
故设金属的相对原子质量为a,则:
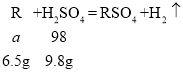
![]()
![]() ,
,
所以该金属为锌;
设第二次消耗的硫酸为![]() ,产生氢气质量为x,
,产生氢气质量为x,
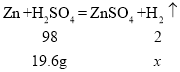
![]() ;
;
![]() 由图中信息可以知道,在前三次加入稀硫酸时,固体质量均减少
由图中信息可以知道,在前三次加入稀硫酸时,固体质量均减少![]() ,但是第四次加入稀硫酸固体质量只减少了
,但是第四次加入稀硫酸固体质量只减少了![]() ,说明第四次中稀硫酸有剩余,所以固体中铜的质量为
,说明第四次中稀硫酸有剩余,所以固体中铜的质量为![]() ,所以铜的质量分数为:
,所以铜的质量分数为:![]() ;
;
![]() 第三次加入稀硫酸充分反应后,生成硫酸锌的质量为y,氢气的质量为z,则:
第三次加入稀硫酸充分反应后,生成硫酸锌的质量为y,氢气的质量为z,则:
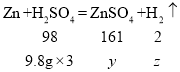
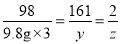
![]() ;
;
若向第三次消耗锌为![]() ,加入稀硫酸充分反应后的溶液中加入
,加入稀硫酸充分反应后的溶液中加入![]() 水,所得不饱和溶液中溶质的质量分数:
水,所得不饱和溶液中溶质的质量分数:![]() ;
;
![]() 设可得到氧化铜的质量是n,
设可得到氧化铜的质量是n,
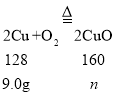
![]()
![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】利用下图所示装置可以进行实验室制备气体。
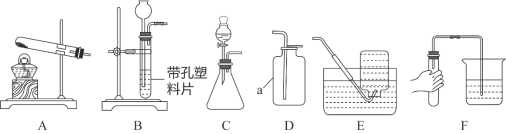
(1)实验室用KMnO4制备O2的化学方程式是______________________________。
(2)选择发生和收集O2的装置,填写在下表中(填字母)。
选用药品 | 发生装置 | 收集装置 |
H2O2溶液、MnO2 | ______ | 收集较纯净O2_______ |
KClO3、MnO2 | ______ | 收集较干燥O2______ |
(3)实验室用上述装置C制取CO2时,该反应生成二氧化碳中常混有少量氯化氢气体,某同学想通过图一装置探究是否有HCl气体,在广口瓶中盛放的试剂是硝酸银溶液,你认为混合气体应从__________(填“a”或“b”)进入。
![]()
(4)制取气体前应先检查的气密性,若按F图所示操作,结果在导管口未看到气泡,其可能原因与下列因素无关的是__________(选填编号)。
A.将烧杯换成水槽 B.将导管伸入水中位置过深,气体无法逸出
C.试管口橡皮塞未塞紧 D.先用手捂住试管,再将导管另一端插入水中