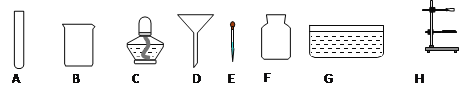
题目内容
【题目】实验是科学探究的重要方法。
实验探究一:气体实验室制法
查阅资料:① 实验室用铜与浓硝酸反应制取NO2气体。
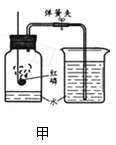
② NO2 是一种红棕色的气体,密度比空气大,能与水反应生成HNO3和NO气体,NO是一种无色气体,NO和NO2都是大气污染物。 根据图所示装置回答有关问题。
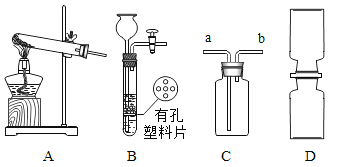
(1)实验室制取NO2气体的发生装置是_____(填装置序号),用C装置收集NO2气体时,NO2应从导管_____(填“a”或“b”)进入。
(2)NO2气体不能用排水法收集的原因(用化学方程式解释)_____。
(3)用D装置演示分子运动实验,为了缩短演示时间,应将盛有NO2的集气瓶 最好放在_____(填“上”或“下”)面,另一瓶是空气。
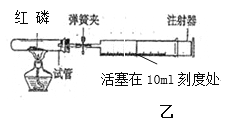
实验探究二:探究影响化学反应速率的因素 以过氧化氢分解为研究对象进行实验。化学小组均采用如图装置进行实验,记录收集10ml氧气的时间。

实验室提供的试剂:2.5%、5%、10%三种 浓度的H2O2溶液;MnO2;CuO;红砖粉末。 数据记录如下:
实验序号 | H2O2 溶液 | 其他物质质量 | 收集 10ml氧气的时间/s |
① | 5ml10% | 0.5g MnO2 | 10 |
② | 5ml10% | 0.5g 红砖粉末 | 60 |
③ | 5ml10% | 0.5g CuO | 20 |
④ | 5ml5% | 0.5g MnO2 | 15 |
(1)小明通过分析实验①②③的数据。
得出结论:MnO2、CuO对H2O2分解有催化作用,红砖粉末无催化作用。
小洪同学对该结论提出疑问,并补充对比实验,其实验操作为:____。 结果:长时间(大于 100s)后,收集到很少量气体。 结论:红砖粉末_____(选填“有”、“无”)催化作用,三者中_____催化效率最高。 写出实验③的反应化学方程式:_________。
(2)小王同学通过分析实验_____(填实验序号)。 得出结论为:当__________时,反应物浓度越大,反应速率越快。
(3)影响化学反应速率的因素还有____________________________。
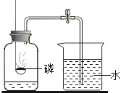
实验探究三:二氧化碳气体与氢氧化钠溶液的反应情况。
化学小组用小烧杯盛装一定量的氢氧化钠溶液并通入一定量的CO2气体进行探究。
(提出问题)
氢氧化钠溶液中通入/span>CO2一段时间后所得的溶液(下面称样品)中会有什么溶质?
(查阅资料)
① 通入少量的二氧化碳时,NaOH与CO2反应的化学方程式_____。
② 通入过量的二氧化碳时,反应的化学方程式为Na2CO3+CO2+H2O= 2NaHCO3
③ 碳酸氢盐都能溶于水,BaCO3难溶于水且是白色固体。
④ Na2CO3、NaHCO3的溶液呈碱性、BaCl2 呈中性
(提出猜想)A.溶质是NaOH、Na2CO3; B.溶质是Na2CO3;C.溶质是Na2CO3、NaHCO3; D.溶质是NaHCO3
(设计实验方案)
实验步骤 | 实验现象 | 实验结论 |
取少量样品于试管中, 滴加几滴_______试液(填酸碱指示剂) | 溶液变红色 | 该溶液显碱性 |
②另取少量样品于试管中, 滴加过量的 BaCl2溶液 | 有白色沉淀生成 | 猜想_____不成立 |
③取步骤②静置后的上层清液,滴入稀盐酸 | 有气泡冒出 | 猜想A和B不成立 |
(得出结论)猜想_____成立
(讨论交流)
(1)同学们讨论后一致认为实验步骤①是多余的。 理由是:_____。
(2)若长时间向澄清石灰水中通入二氧化碳会看到什么样的现象呢? 现象是:_____。
【答案】B a ![]() 上 取5ml10%H2O2溶液不放入任何催化剂记录产生10ml氧气时间 有
上 取5ml10%H2O2溶液不放入任何催化剂记录产生10ml氧气时间 有 ![]()
![]() ①和④ 催化剂相同 温度
①和④ 催化剂相同 温度 ![]() 无色酚酞 D C NaOH溶液、Na2CO3溶液、NaHCO3溶液都显碱性 澄清石灰水先变浑浊,再慢慢变澄清
无色酚酞 D C NaOH溶液、Na2CO3溶液、NaHCO3溶液都显碱性 澄清石灰水先变浑浊,再慢慢变澄清
【解析】
实验探究一:气体实验室制法
(1)根据资料可知实验室用铜与浓硝酸反应制取 NO2 气体,反应物为固体和液体,不需要加热,因此实验室制取 NO2 气体的发生装置是固液不加热型,即装置B,NO2密度比空气大,用 C 装置收集NO2气体时,NO2 应从导管a进入。
(2)NO2 气体不能用排水法收集的原因NO2能与水反应生成HNO3和NO气体,反应的化学方程式为![]() 。
。
(3)NO2 是一种红棕色的气体,密度比空气大,用D装置演示分子运动实验,为了缩短演示时间,应将盛有 NO2 的集气瓶最好放在上面,另一瓶是空气。
实验探究二:探究影响化学反应速率的因素 以过氧化氢分解为研究对象进行实验。
(1)小明通过分析实验①②③的数据。
得出结论:MnO2、CuO对H2O2分解有催化作用,红砖粉末无催化作用。
小洪同学对该结论提出疑问,并补充对比实验,探究无红砖粉末情况下,5ml10%分解产生10ml氧气的时间,其实验操作为:取 5mL10%H2O2 溶液不放入任何催化剂记录产生 10ml氧气时间。
结果:长时间(大于 100s)后,收集到很少量气体。
根据收集10ml氧气的时间可以得出结论:红砖粉末有催化作用,三者中![]() 催化效率最高。
催化效率最高。
实验③是以氧化铜为催化剂分解过氧化氢生成氧气和水,反应化学方程式为![]() 。
。
(2)根据实验①和④的条件和时间数据可以得出结论为:当催化剂相同时,反应物浓度越大,反应速率越快。
(3)除了催化剂之外,影响化学反应速率的因素还有温度等。
实验探究三:二氧化碳气体与氢氧化钠溶液的反应情况。
用小烧杯盛装一定量的氢氧化钠溶液并通入一定量的CO2气体进行探究。
提出问题:氢氧化钠溶液中通入CO2一段时间后所得的溶液(下面称样品)中会有什么溶质?
查阅资料:
① 通入少量的二氧化碳时,NaOH与CO2反应生成碳酸钠和水,反应的化学方程式为![]() 。
。
② 通入过量的二氧化碳时,反应的化学方程式为Na2CO3+CO2+H2O= 2NaHCO3
③ 碳酸氢盐都能溶于水,BaCO3难溶于水且是白色固体。
④ Na2CO3、NaHCO3的溶液呈碱性、BaCl2 呈中性
提出猜想:
A.溶质是NaOH、Na2CO3;
B.溶质是Na2CO3;
C.溶质是Na2CO3、NaHCO3;
D.溶质是NaHCO3
设计实验方案:
实验步骤①:取少量样品于试管中, 滴加几滴无色酚酞试液,发现溶液变红色,说明该溶液显碱性;
实验步骤②:另取少量样品于试管中,滴加过量的 BaCl2溶液,发现有白色沉淀生成,猜想D不成立;
实验步骤③:取步骤②静置后的上层清液,滴入稀盐酸,发现有气泡冒出,猜想A和B不成立;
得出结论:猜想C成立;
讨论交流:
(1)同学们讨论后一致认为实验步骤①是多余的,理由是:NaOH 溶液、Na2CO3溶液、NaHCO3 溶液都显碱性。
(2)向澄清石灰水中通入二氧化碳,氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,澄清石灰水变浑浊,继续通入二氧化碳,碳酸钙与二氧化碳、水继续反应生成碳酸氢钙,沉淀消失,石灰水又变澄清。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案