题目内容
乙醇俗称酒精,在生活中用途广泛,工业上可用来制造醋酸、饮料、香精、染料、燃料等,医疗上也常用体积分数为70%~75%的乙醇作消毒剂。某校初三学生在老师的指导下对乙醇的一些性质进行了实验探究:
【探究活动一】乙醇的化学式是C2H5OH,在NaOH一样含有“OH”,那么乙醇是不是碱呢?请你试设计一种方案加以验证.
| 实验步骤 | 实验现象 | 实验结论 |
| | | 乙醇不是碱 |
【探究活动二】根据质量守恒定律,小李同学认为乙醇(C2H5OH)完全燃烧时生成CO2和H2O,如果氧气不足,乙醇燃烧可生成CO、CO2和H2O。
查阅资料:无水硫酸铜固体遇水由白色变蓝色,生成五水硫酸铜(CuSO4?5H2O),一氧化碳具有还原性,高温或加热时能将许多金属氧化物还原金属单质,因此常用于金属的冶炼.碱石灰是氧化钙和氢氧化钠的混合物,具有很强的吸水性,并能吸收酸性气体。
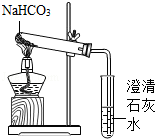
在老师的指导下,同学们用如图所示的装置进行实验,确证乙醇燃烧产物中有CO、CO2和H2O。请回答下列问题:

(1)B装置的作用是 ;C装置的作用是 ;D装置的作用是 。
(2)能确证产物中有H2O的现象是 。实验时,同学们还观察到B、F装置中澄清石灰水变浑浊,C装置中有气泡冒出,E装置中黑色粉末变成红色,说明该乙醇燃烧产物中有CO、CO2和H2O生成.请写出E装置中发生反应的化学方程式: 。
(3)为了保护环境,应在装置的排气管口采取的措施是 。
(4)小明同学在反应的过程中发现C装置内除了气体通过溶液时产生气泡之外,没有明显变化现象,所以他认为C装置中没有发生化学反应,小红同学认为通过C装置气体中仍有部分二氧化碳与氢氧化钠溶液发生化学反应,为了确证C装置中是否发生化学变化,他们设计了以下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| | | 小红同学的想法是正确的,有关实验现象的反应化学方程式为 |
实验步骤 实验现象 实验结论 取少量乙醇于试管中,滴加无色酚酞试液 溶液不变色 乙醇不是碱
(1)证明乙醇燃烧气体产物中含有二氧化碳;吸收混合气体中的二氧化碳;除去气体从BC装置中带出的水分;(2)A中白色固体变成蓝色;CO+CuO Cu+CO2;(3)点燃或收集尾气;(4)
Cu+CO2;(3)点燃或收集尾气;(4)
CaCl2+Na2CO3═CaCO3↓+2NaCl实验步骤 实验现象 实验结论 取反应后C装置中的少量溶液于试管中,滴加氯化钙溶液 产生白色沉淀 小红同学的想法是正确的,有关实验现象的反应化学方程式为 CaCl2+Na2CO3═CaCO3↓+2NaCl
解析试题分析:【探究活动一】用酸碱指示剂测定乙醇是否属于碱,因为碱能使酚酞试液变红,所以取少量乙醇于试管中,滴加无色酚酞试液,溶液不变红,说明乙醇不是碱;
【探究活动二】(1)二氧化碳能使澄清石灰水变浑浊,所以用澄清石灰水来验证二氧化碳的存在,即证明乙醇燃烧气体产物中含有二氧化碳;氢氧化钠能与二氧化碳反应生成碳酸钠和水,所以氢氧化钠溶液是为了吸收混合气体中的二氧化碳;碱石灰具有吸水性,所以D装置的作用是除去气体从BC装置中带出的水分;
(2)根据无水硫酸铜固体遇水由白色变蓝,可知用无水硫酸铜来验证水的存在就可以,能确证产物中有H2O的现象是A中白色固体变成蓝色;E装置中反应物是一氧化碳和氧化铜,生成物是铜和二氧化碳,反应条件是加热,所以方程式是:CO+CuO Cu+CO2。
Cu+CO2。
(3)由于一氧化碳有毒,直接排放在空气中会污染环境,所以将尾气点燃或收集起来再处理都可以;
(4)二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,只要能验证出碳酸根离子的存在就行。因为碳酸钠与氯化钙反应生成碳酸钙白色沉淀和氯化钠,所以取反应后C装置中的少量溶液于试管中,滴加氯化钙溶液,有白色沉淀产生,说明小红同学的想法是正确的;反应物是碳酸钠和氯化钙,生成物是碳酸钙沉淀和氯化钠,用观察法配平,碳酸钙后面标上沉淀符号,所以方程式是:CaCl2+Na2CO3=CaCO3↓+2NaCl。
考点:考查实验探究物质的性质或变化规律;常见气体的检验与除杂方法;碱的化学性质;溶液的酸碱性测定;盐的化学性质;书写化学方程式

 全能测控期末小状元系列答案
全能测控期末小状元系列答案为了解环境因素对维生素C含量的影响,从而更好地保存有关食物,某兴趣小组同学根据维生素C可使高锰酸钾(KMn04;)溶液褪色的原理,进行了如下表所示的实验。
| 编号 | 维生素C溶液的处理方法 | 使40毫升KMn04溶液褪色的平均滴数 |
| 1 | 放置于室内暗处0.5小时 | 15 |
| 2 | 强烈阳光直射5小时后,放置于室内暗处0.5小时 | 22 |
| 3 | 煮沸l0分钟后,放置于室内暗处0.5小时 | 21 |
(1)他们探究了_______ ____对维生素C含量的影响;
(2)他们的探究对我们启示是:在贮存富含维生素C的食物时,应________________,以防止其中的维生素C过量流失,降低食物的营养价值;
(3)为了解维生素C的化学性质,他们用pH试纸测得该维生素C溶液的pH在1至2之间,说明维生素C具有________性。
实验课上,小舟同学向盛有澄清石灰水的烧杯中加入过量的碳酸钠溶液,生成白色沉淀,过滤后得到无色溶液,他说:“我制得了氢氧化钠溶液!”
(1)小帆同学却说:“这种无色溶液中不一定含有氢氧化钠”他做了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 用试管取无色溶液少许,滴入2滴无色酚酞试液 | 无色酚酞试液变红 | 无色溶液中含有氢氧化钠 |
小玉认为小帆的实验方案也不严密,不能证实无色溶液中一定含有氢氧化钠,理由是: 。
(2)小玉设计了另一个实验:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入 ②过滤,向滤液中滴加几滴硫酸铜溶液 | ③ ④ | 无色溶液中确实含有氢氧化钠 |
(3)小玉的实验可靠性高的原因是① 、② 。
甲同学对寒痛乐熨剂(简称“寒痛乐”)的发热原理产生了浓厚兴趣,于是带了几包寒痛乐,来到实验室对其进行研究。

【查阅资料】
[ 用法用量 ] 外用,一日1次。将外袋剪开,取出药袋,晃动数次,使药物充分松散,接触空气,手摸有热感时,置于固定袋内,覆盖于痛患处,每袋可发热不少于15小时。
[ 原料层 ] 铁、蛭石、活性炭、水等。
[ 作用原理 ] 铁跟氧气和水反应生成氢氧化铁(固体),并放热。
【实验一】验证寒痛乐成分中所含铁的化学性质。
| 步骤 | 实验操作 | 实验现象 |
| | 将寒痛乐打开,将药物倒入一烧杯中,观察 | 药物为黑色固体粉末 |
| | 用一条形磁铁与烧杯中的黑色粉末充分接触,取适量吸附在磁铁上的黑色粉末放于燃烧匙中,在酒精灯上点燃后伸入盛有氧气的集气瓶中,观察 | 剧烈燃烧, |
实验结论:写出此反应的文字表达式 。
集气瓶中加水的作用是 。
【实验二】用寒痛乐熨剂药粉测定空气中氧气的含量。
甲同学设计了如下图所示装置,进行实验。

【实验记录
| 步骤 | 实验操作 | 主要实验现象 | 实验结论及解释 |
| | 连接好装置如上图所示,然后 | | 装置的气密性良好 |
| | 加入足量药品,迅速将胶塞盖严,并充分振荡 | | 进入集气瓶内水的体积即为空气中氧气的含量。 |
【实验反思】乙同学认为甲同学所做“寒痛乐药粉测定空气中氧气的含量”的实验不能证明上述结论,他将操作改进后再进行测量,得到了较为准确的结果。他改进后的操作为
。
闽东毗邻东海,海洋资源十分丰富.从海水中提取氯化钠并以氯化钠和水为原料制取氢氧化钠、氯气等物质的工艺流程图如下:
某兴趣小组进行如下实验:
【实验一】除去粗盐中的不溶性杂质
步骤一:用托盘天平称取5.0g粗盐,用药匙将该粗盐逐渐加入盛10mL水的烧杯中,边加边用玻璃棒搅拌,一直加到粗盐不再溶解为止.称量剩下的粗盐质量为1.4g
步骤二:经过过滤、蒸发,得到3.2g精盐.
(1)计算精盐的产率 (保留一位小数).
(2)该小组测得的产率偏低,可能的原因是 .
A.溶解时未充分搅拌
B.蒸发时水分未蒸干
C.蒸发时盐粒溅出蒸发皿
(3)步骤一、二的部分操作如图所示,其中错误的是 (填字母序号).
【实验二】探究工艺流程图步骤Ⅱ所得的氯化钠溶液中MgCl2是否除尽,溶液中是否含有CaCl2
[查阅资料]有关物质的溶解性表(20℃)
| 阴离子 阳离子 | OH﹣ |  |
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤一:取一定量的氯化钠溶液于试管中,加入适量的NaOH溶液 | 无明显现象 | 说明MgCl2 (填“已”或“未”)除尽 |
| 步骤二:往步骤一所得溶液中加入适量的 溶液 | 产生白色沉淀 | 说明溶液中含有CaCl2 |
(1)工艺流程图步骤Ⅰ从海水中得到粗盐,采用风吹日晒蒸发溶剂的方法,而不是采用降低溶液温度的方法,原因是 .
(2)写出工艺流程图步骤Ⅳ的化学方程式 .