题目内容
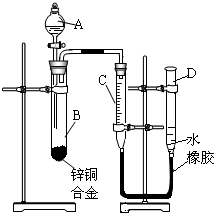 某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.
某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.(1)实验前,先将锌铜合金在稀酸中浸泡片刻,其目的是:
除去合金表面的氧化膜
除去合金表面的氧化膜
;(2)实验操作步骤有:检查气密性,将药品和水装入各仪器中,连接好装置后,再进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性.上述再进行的操作的顺序是
⑤①④③②
⑤①④③②
(填序号);记录C的液面位置时,除视线平视外,还应使D和C的液面相平
使D和C的液面相平
;(3)B中发生反应的化学方程式为
Zn+H2SO4═ZnSO4+H2↑
Zn+H2SO4═ZnSO4+H2↑
;(4)若实验用锌铜合金的质量为a g,与酸充分反应后,测得氢气体积为V L,为求出合金中锌、铜的质量分数,还缺少的一个数据是
D
D
;A.反应前加入稀酸的体积 B.反应前加入稀酸的质量分数
C.实验前反应装置中空气的体积 D.实验条件下氢气的密度
(5)若实验用锌铜合金的质量为a g,与酸充分反应后,B中剩余固体的质量为b g,则锌的质量分数为
(a-b)/a×100%
(a-b)/a×100%
;(6)实验过程中,若未洗涤过滤所得的不溶物,则测得锌的质量分数将
偏小
偏小
(填“偏大”“偏小”或“不受影响”).分析:(1)实验前,先将锌铜合金在稀酸中浸泡片刻,除去合金表面的氧化膜;
(2)要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行处理;注意读数的方法;
(3)测定铜锌合金中锌、铜的质量分数,可以依据锌能与酸反应生成氢气而铜不可以来进行,所用的酸可以是稀盐酸也可以是稀硫酸,则可书写化学方程式;
(4)要求氢气的质量,除了知道氢气的体积,还需要知道氢气的密度;
(5)铜锌合金的质量为ag,B中剩余固体的质量为bg,则锌的质量为(a-b)g,从而可以求得锌的质量分数;
(6)未洗涤过滤所得的不溶物,会导致锌的质量偏小.
(2)要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行处理;注意读数的方法;
(3)测定铜锌合金中锌、铜的质量分数,可以依据锌能与酸反应生成氢气而铜不可以来进行,所用的酸可以是稀盐酸也可以是稀硫酸,则可书写化学方程式;
(4)要求氢气的质量,除了知道氢气的体积,还需要知道氢气的密度;
(5)铜锌合金的质量为ag,B中剩余固体的质量为bg,则锌的质量为(a-b)g,从而可以求得锌的质量分数;
(6)未洗涤过滤所得的不溶物,会导致锌的质量偏小.
解答:解:(1)实验前,先将锌铜合金在稀酸中浸泡片刻,除去合金表面的氧化膜;
(2)要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行处理,所以本题答案为:⑤①④③②;);记录C的液面位置时,除视线平视外,还应 使D和C的液面相平;
(3)依据锌能与酸反应生成氢气而铜不可以来进行,所用的酸可以是稀盐酸也可以是硫酸,所以本题答案为:Zn+2HCl═ZnCl2+H2↑(或Zn+H2SO4═ZnSO4+H2↑);
(4)要求氢气的质量,除了知道氢气的体积,还需要知道氢气的密度,所以本题答案为:D;
(5)铜锌合金的质量为ag,B中剩余固体的质量为bg,则锌的质量为(a-b)g,从而可以求得锌的质量分数为
×100%,所以本题答案为:
×100%;
(6)未洗涤过滤所得的不溶物,会导致铜的质量偏大,从而锌的质量偏小,得到锌的质量分数将偏小,所以本题答案为:偏小.
故答为:
(1)除去合金表面的氧化膜
(2)⑤①④③②;使D和C的液面相平
(3)Zn+H2SO4═ZnSO4+H2↑
(4)D
(5)(a-b)/a×100%
(6)偏小
(2)要根据排开液体的体积来测定生成氢气的体积,首先需记录C的液面,然后使反应进行,当充分反应时在记下C的位置,最后可以对剩余固体进行处理,所以本题答案为:⑤①④③②;);记录C的液面位置时,除视线平视外,还应 使D和C的液面相平;
(3)依据锌能与酸反应生成氢气而铜不可以来进行,所用的酸可以是稀盐酸也可以是硫酸,所以本题答案为:Zn+2HCl═ZnCl2+H2↑(或Zn+H2SO4═ZnSO4+H2↑);
(4)要求氢气的质量,除了知道氢气的体积,还需要知道氢气的密度,所以本题答案为:D;
(5)铜锌合金的质量为ag,B中剩余固体的质量为bg,则锌的质量为(a-b)g,从而可以求得锌的质量分数为
| a-b |
| a |
| a-b |
| a |
(6)未洗涤过滤所得的不溶物,会导致铜的质量偏大,从而锌的质量偏小,得到锌的质量分数将偏小,所以本题答案为:偏小.
故答为:
(1)除去合金表面的氧化膜
(2)⑤①④③②;使D和C的液面相平
(3)Zn+H2SO4═ZnSO4+H2↑
(4)D
(5)(a-b)/a×100%
(6)偏小
点评:本题探究了铜锌合金中铜和锌的质量分数的测定,完成此题,可以依据铜和锌的性质,根据题干提供的信息进行.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
 某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.
某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.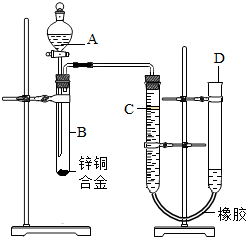 (2012?宝应县二模)某学习小组用如图所示装置测定锌铜合金中铜的质量分数.(已知:金属与酸时放出一定的热量)
(2012?宝应县二模)某学习小组用如图所示装置测定锌铜合金中铜的质量分数.(已知:金属与酸时放出一定的热量) 某学习小组用如图所示装置测定锌铜合金中铜的质量分数.(已知:金属与酸时放出一定的热量)
某学习小组用如图所示装置测定锌铜合金中铜的质量分数.(已知:金属与酸时放出一定的热量)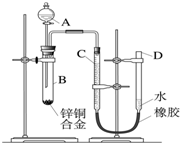 某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.
某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.