题目内容
过氧化钙(CaO2)具有较强的漂白、杀菌消毒作用,对环境无危害,是一种很有应用价值和发展前途的化工产品.工业上利用双氧水和氢氧化钙制备CaO2,已知:双氧水高温下不稳定、会分解.如图是简化后的工艺流程,请回答下列问题.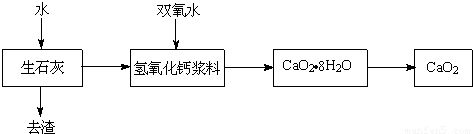
(1)生石灰中加水发生的化学反应方程式是______,该反应是______反应(填“放热”或“吸热”).在加入双氧水前,氢氧化钙浆料需经过______处理(填“保温”、“升温”、“降温”)处理.
(2)氢氧化钙浆料中加入双氧水的反应属于化合反应,则反应方程式为______,获得的产品CaO2?8H2O的相对分子质量为______,其中Ca、O、H的元素质量比为______.
(3)CaO2常用于鱼虾运输过程中的供氧剂,其反应原理是:2CaO2+2______=2Ca(OH)2+O2↑,若需要提供12.8g氧气,则需要CaO2______g.Na2O2也能与水反应原理与CaO2相同,但却不能作为鱼虾运输的供氧剂,请分析其原因______.
【答案】分析:(1)根据生石灰能与水化合生成了氢氧化钙,放出大量的热,写出反应的方程式; 根据双氧水高温下不稳定、会分解,分析对氢氧化钙浆料的处理方法;
(2)根据氢氧化钙与双氧水的反应,写出反应的方程式,根据化学式计算相对分子质量及各元素的质量比;
(3)根据质量守恒定律分析空白处的物质,根据化学方程式由氧气的质量进行计算需要的CaO2质量,根据Na2O2与水反应的生成物的性质分析.
解答:解:(1)生石灰与水化合生成了氢氧化钙,反应的方程式是:CaO+H2O=Ca(OH)2;在该反应中放出大量的热.由于 双氧水高温下不稳定、会分解.所以,
氢氧化钙浆料需经过降温处理;
(2)氢氧化钙与双氧水的反应的方程式是:Ca(OH)2+H2O2+6H2O=CaO2?8H2O,CaO2?8H2O的相对分子质量为:40+16×2+(1×2+16)×8=216,其中Ca、O、H的元素质量比为:40:(16×10):(1×16)=40:160:16;
(3)根据质量守恒定律可知,反应前后各元素原子的种类及数目不变,由反应可知空白处应填入的物质是H2O.
设需要提供12.8g氧气,则需要CaO2 的质量为x
2CaO2+2H2O=2Ca(OH)2+O2↑
144 32
x 12.8g
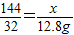 解得:x=57.6g
解得:x=57.6g
由题意可知:Na2O能与水反应生成了NaOH,NaOH有强碱性,不利于鱼虾生存.所以,Na2O2不能作为鱼虾运输的供氧剂,
故答为:(1)CaO+H2O=Ca(OH)2 放热,降温;(2)Ca(OH)2+H2O2+6H2O=CaO2?8H2O,216,40:160:16;(3)H2O,57.6,因Na2O2与水反应生成的NaOH有强碱性,不利于鱼虾生存.
点评:本题主要是根据化学方程式计算的基本题型,难点在于反应化学方程式的书写,体现了学生自主学习的能力.
(2)根据氢氧化钙与双氧水的反应,写出反应的方程式,根据化学式计算相对分子质量及各元素的质量比;
(3)根据质量守恒定律分析空白处的物质,根据化学方程式由氧气的质量进行计算需要的CaO2质量,根据Na2O2与水反应的生成物的性质分析.
解答:解:(1)生石灰与水化合生成了氢氧化钙,反应的方程式是:CaO+H2O=Ca(OH)2;在该反应中放出大量的热.由于 双氧水高温下不稳定、会分解.所以,
氢氧化钙浆料需经过降温处理;
(2)氢氧化钙与双氧水的反应的方程式是:Ca(OH)2+H2O2+6H2O=CaO2?8H2O,CaO2?8H2O的相对分子质量为:40+16×2+(1×2+16)×8=216,其中Ca、O、H的元素质量比为:40:(16×10):(1×16)=40:160:16;
(3)根据质量守恒定律可知,反应前后各元素原子的种类及数目不变,由反应可知空白处应填入的物质是H2O.
设需要提供12.8g氧气,则需要CaO2 的质量为x
2CaO2+2H2O=2Ca(OH)2+O2↑
144 32
x 12.8g
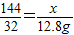 解得:x=57.6g
解得:x=57.6g 由题意可知:Na2O能与水反应生成了NaOH,NaOH有强碱性,不利于鱼虾生存.所以,Na2O2不能作为鱼虾运输的供氧剂,
故答为:(1)CaO+H2O=Ca(OH)2 放热,降温;(2)Ca(OH)2+H2O2+6H2O=CaO2?8H2O,216,40:160:16;(3)H2O,57.6,因Na2O2与水反应生成的NaOH有强碱性,不利于鱼虾生存.
点评:本题主要是根据化学方程式计算的基本题型,难点在于反应化学方程式的书写,体现了学生自主学习的能力.

练习册系列答案
相关题目

 (2009?泉港区质检)周末,小萌与爸爸经过一鱼塘边,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡.经咨询得知,这种固体俗称“鱼浮灵”,主要成分是过氧化钙(CaO2).
(2009?泉港区质检)周末,小萌与爸爸经过一鱼塘边,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡.经咨询得知,这种固体俗称“鱼浮灵”,主要成分是过氧化钙(CaO2). (2013?崇安区二模)长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气.过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一问题中进行探究,请你参与.
(2013?崇安区二模)长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气.过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一问题中进行探究,请你参与.