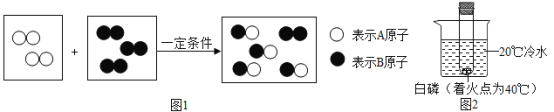
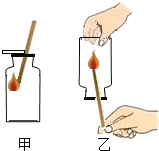
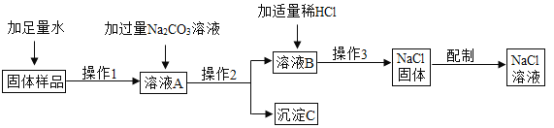
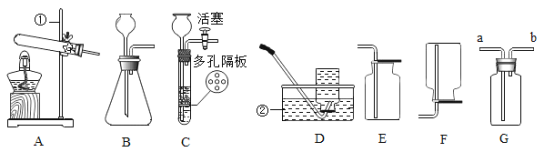
��Ŀ����
����Ŀ����ͼ��a��b��c�������ʵ��ܽ�����ߡ����з�������ȷ���� �� ��
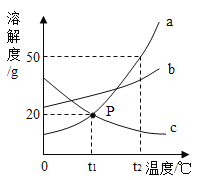
A. t2��ʱ,a��b��c�������ʵ��ܽ���ɴ���С��˳����a>b>c
B. t2��ʱ,��50ga���ʷ���100g ˮ�г���ܽ�õ�a�ı�����Һ(a���ʲ����ᾧˮ)
C. ��t2��ʱa��b��c�������ʵı�����Һ������t1��ʱ,������Һ��������������ϵ��b>a=c
D. t2��ʱ,����������a��b��Һ���µ�t1�������ľ�������a>b
���𰸡�CD
��������
A��t2��ʱ��a��b��c�������ʵ��ܽ���ɴ�С��˳����a��b��c������ȷ��
B��t2��ʱ��a���ܽ����50g����100gˮ������ܽ�50g��a�����Խ�50g a���ʷ���100gˮ�г���ܽ�õ�a�ı�����Һ������ȷ��
C��ab���ܽ�����¶����߶�����c���ܽ�����¶����߶���С�����Խ�t2��ʱa��b��c�������ʵı�����Һ������t1��ʱ��ab�������壬���ʵ�����������С��c�ܽ���������ʵ������������䣬�뽵��ǰ��ȣ��ݱ�����Һ�����ʵ����������ļ���ʽ![]() �����ܽ��Խ����������Ҳ��Խ��t1��ʱb���ܽ�ȴ���a���ܽ�ȴ���t2��ʱc���ܽ�ȣ����Դ�ʱ��Һ������������ϵ��b��a��c���ʴ���
�����ܽ��Խ����������Ҳ��Խ��t1��ʱb���ܽ�ȴ���a���ܽ�ȴ���t2��ʱc���ܽ�ȣ����Դ�ʱ��Һ������������ϵ��b��a��c���ʴ���
D��û��˵��ab�Ƿ�Ϊ������Һ��a�Ƿ��������岻ȷ�����ʴ���ѡCD��

 ��У����ϵ�д�
��У����ϵ�д�