��Ŀ����
����Ŀ��ij��ѧ��ȤС��Խ�����������������̽������������������������ݡ�
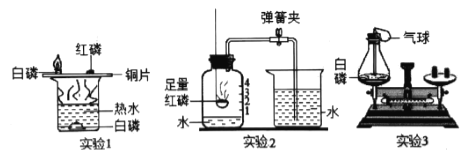
��1��̽���������ԭ������ͼ����ÿ֧�Թ��о�������ȫ��ͬ�Ľྻ��������
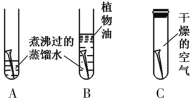
��һ��ʱ����ͬѧ�۲쵽��______ �Թ��е��������������ˡ��ɴ˵ó��������ԭ��������______________��ͬ���õĽ����
��Ϊ��ֹ������ʴ�����Բ�ȡ�Ĵ�ʩ��____________����һ�֣���
���ں�������Ʒǰ������ϡ��������������⣬�÷�Ӧ�Ļ�ѧ����ʽ��______________________��
��2��ijͬѧ�ֱ���ʢ����״����С��ͬ����Ƭ��пƬ���Թ��У��������������������������ͬ��ϡ���ᣬ�� ��_________________________________��Ϊ�������ж����ֽ����Ļ��ǿ����
��3����һ�����������۷�������ͭ������п�Ļ����Һ�У���ַ�Ӧ����ˣ����ù�����һ�����е�������______��������Һ��һ�����е�������____________________���ѧʽ����
���𰸡�A ������ˮ ������Ʒ����ˢ�� Fe2O3+6HCl�T2FeCl3+3H2O ��������������ݵĿ���������ҳ̶ȣ� Cu ZnSO4��FeSO4
��������
��1����һ��ʱ��۲��Թ�A�е�����������ʴ����ΪA�Թ��м��ṩ��������Ҳ�ṩ��ˮ���ɴ˵ó������������Ҫ����������ˮ������ֱ�ӽӴ������A��������ˮ��
�ڷ�������ƻ������������������������Ʒ����ˢ�ᡢͿ�͵ȣ����������Ʒ����ˢ�
���������Ҫ�ɷ����������������������ᷴӦ�����Ȼ�����ˮ����ѧ����ʽΪ��Fe2O3+6HCl�T2FeCl3+3H2O�����Fe2O3+6HCl�T2FeCl3+3H2O��
��2��ijͬѧ�ֱ���ʢ����״����С��ͬ����Ƭ��пƬ���Թ��У��������������������������ͬ��ϡ���ᣬ�ԡ���������������ݵĿ���������ҳ̶ȣ���Ϊ�������ж����ֽ����Ļ��ǿ������������Խ�죬˵�������Ļ��Խǿ�������������������ݵĿ���������ҳ̶ȣ���
��3�����ֽ��������ǿ������˳��п������ͭ����֪��ֻ���û���ͭ��������������ͭ��Ӧ�ķ���ʽ��Fe+CuSO4�TCu+FeSO4����֪��ַ�Ӧ����ˣ����ù�����һ�����е�������ͭ��������Һ��һ�����з�Ӧ���ɵ�FeSO4������û�вμӷ�ӦZnSO4�����Cu��ZnSO4��FeSO4��

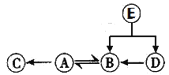
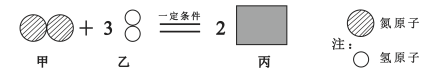
����Ŀ��A B C D��ʾ4�����ʣ�����ʾ��ͼ���±���A��B��һ�������·�Ӧ����C��D������˵������ȷ����
���� | A | B | C | D |
|
��ʾ ��ͼ |
|
|
|
|
A.B�Ļ�ѧʽΪSO2
B.���ɵ�CΪ����
C.�μӷ�Ӧ��A��B���Ӹ�����Ϊ2:1
D.16gB�μӷ�Ӧ��������C������Ϊ8g