题目内容
【题目】某同学欲测定草木灰中碳酸钾的含量,称取 69g 试样于烧杯中,加入 29.2g 稀盐酸恰好完全反应,反应后,称得烧杯内混合物的总质量为 93.8g(忽略二氧化碳的溶解对质量的影响)。(可能发生的反应有:K2CO3+2HCl=2KCl+H2O+CO2↑)请计算:
(1)反应过程中产生的二氧化碳质量为_____g。
(2)该草木灰试样中碳酸钾的质量分数。_____
【答案】4.4 20%
【解析】
(1)根据质量守恒定律,化学反应前后物质的总质量相等。因此反应过程中产生的二氧化碳质量为:69g+29.2g-93.8g=4.4g。
(2)设草木灰试样中碳酸钾的质量为x。
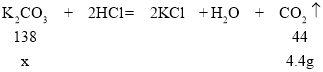
![]()
解得x=13.8g
草木灰试样中碳酸钾的质量分数为:![]()
答:(1)反应过程中产生的二氧化碳质量为4.4g。(2)该草木灰试样中碳酸钾的质量分数为20%。

练习册系列答案
相关题目
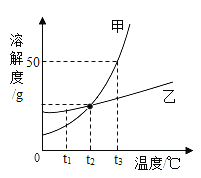
【题目】MgSO4和KCl的溶解度表及溶解度曲线如下。下列说法正确的是

温度/°C | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | |
溶解度S/g | MgSO4 | 33.7 | 38.9 | 44.5 | 50.6 | 54.6 | 55.8 | 52.9 | 51.1 |
KCl | 34.2 | 37.2 | 40.1 | 42.6 | 45.8 | 48.8 | 51.0 | 53.3 | |
A.甲为MgSO4
B.t1°C应介于20°C~30°C
C.乙的饱和溶液从t4降温到t2的过程中,溶质质量分数保持不变
D.等质量甲、乙饱和溶液从t1升温到t3,为使其溶液仍饱和,加入固体质量:甲>乙