题目内容
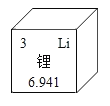
【题目】科学家因锂离子电池发展的研究获诺贝尔化学奖。结合图示,有关锂的说法正确的是
A.属于非金属元素
B.相对原子质量是6.941g
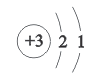
C.![]() 表示核内有3个电子
表示核内有3个电子
D.离子符号是Li+.
【答案】D
【解析】
在元素周期表中的每一个单元中可以得知元素的四部分信息,其中左上角的数字表示原子序数,右上角的符号表示元素的符号,中间的汉字是元素名称,下面的数字是相对原子质量。在原子结构示意图中,圆圈代表原子核,圈内的数字表示质子数或核电荷数,“+”表示原子核带正电,弧线表示原子层,弧线中间的数字表示该电子层的电子数。
A、锂元素的偏旁是金字旁,属于金属元素,故选项A错误;
B、相对原子质量是原子的实际质量与一种碳原子质量的十二分之一相比较所得的比值,因此单位是1,不是g,故选项B错误;
C、原子结构示意图中圆圈及圆圈内的数字表示的是原子核和核内的质子数,故选项C错误;
D、根据锂原子的结构示意图知,锂原子最外层电子数是1,容易失去一个电子形成阳离子,离子符号是Li+,故选项D正确。故选:D。

 轻松课堂单元期中期末专题冲刺100分系列答案
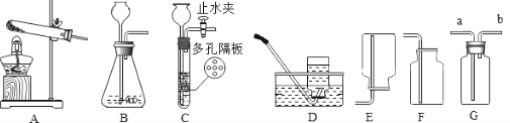
轻松课堂单元期中期末专题冲刺100分系列答案【题目】下图是初中化学常用的实验装置,请根据实验要求选择适当的装置并完成相关问题。

①写出编号仪器的名称:a___________;b__________。
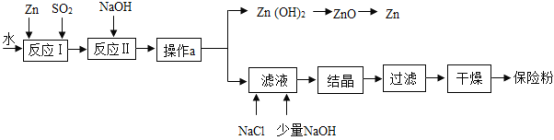
②实验室欲制取并收集干燥的二氧化碳气体,应选用的装置依次为______________(填仪器编号),反应方程式是_____________。将生成的气体通入装置 D,若无明显现象,可能的原因是(装置气密性良好)______________。
③某小组欲探究二氧化锰的用量对氯酸钾分解速率的影响设计了如下实验:用 9 g 的氯酸钾分别与不同质量的二氧化锰混合加热(反应过程中其他条件均相同)记录从开始加 热到收集满一集气瓶氧气(约 250 mL)所需的时间,如下表:
氯酸钾质量(g) | 9 | 9 | 9 |
二氧化锰质量(g) | 1 | 2 | 3 |
完成实验的时间(s) | 60 | 55 | 23 |
该实验应选用的发生装置是____________,反应方程式是____________ 。甲同学认为用装置 G 收集,乙同学认为应该用装置 H 收集,你认为应采用装置_________(填仪器编号)收集更适合该项实验,理由是_________。
【题目】如图是a、b、c三种物质的溶解度曲线。根据图回答:
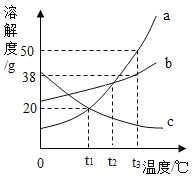
(1)_____℃时,a和c的溶解度相等。
(2)t3℃时,把20ga、b、c三种物质分别加入盛有50g水的烧杯中不断搅拌,所得溶液的溶质质量分数大小关系为_____(填选项字母,下同);若将温度降低到t1℃时,溶液质量的大小关系为_____。
A c>a=bB b>a=cC a>b>cD b>a>c
(3)在t2℃时,将c物质的不饱和溶液变为饱和溶液,下列有关说法不正确的是_____(填字母)。
A 溶剂的质量可能变小B 溶液的质量可能变大
C 溶质的质量分数一定变大D 溶质的质量一定不变
(4)将纯净的氯化钠配制成溶液。20℃时,向4个盛有200g水的烧杯中,分别加入一定质量的氯化钠并充分溶解。4组实验数据如下:
实验序号 | ① | ② | ③ | ④ |
加入氯化钠的质量/g | 9 | 36 | 81 | 90 |
溶液质量/g | 209 | 236 | 272 | 272 |
若将①中得到的溶液稀释成质量分数为0.9%的生理盐水,需加水的质量是_____g。
关于上述实验的叙述正确的是_____(填序号)。
a、①②所得溶液是不饱和溶液
b、③④所得溶液中,溶质的质量分数不相等
c、20℃时,200g水中最多溶解氯化钠的质量为72g
d、20℃时,将④继续恒温蒸发100g水,过滤,得到质量为36g的固体
(5)现有两种金属单质组成的混合物。向100g某稀盐酸中加入该混合物(假设能与酸反应的的金属都能全部反应),混合物的质量与生成氢气的质量关系如图所示。
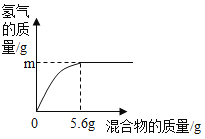
下列说法正确的是_____(填序号)。
a、若混合物为Zn、Al,则m可能是0.2g
b、若混合物为Zn、Cu,则m一定大于0.2g
c、若混合物为Fe、Al,则稀盐酸中溶质质量分数不一定大于7.3%
d、若混合物为Fe、Cu,m为0.1g,则该混合物中Fe的质量分数一定是50%