题目内容
【题目】化学活动课上,老师给同学们表演了一个“水能生火”的魔术,把脱脂棉放在石棉网上,向脱脂棉上滴加了几滴水,脱脂棉立刻燃烧起来。通过查阅资料可知,过氧化钠和水反应的产物只有两种,都是初中化学常见物质,根据所学化学知识回答:
(1)从燃烧的条件分析可知,过氧化钠(Na2O2)和水发生反应生成了可以支持物质燃烧的__,反应_____(填“吸收”或“放出”)大量的热。
(2)根据质量守恒定律可推测另一种产物必含的元素是_______。
(3)过氧化钠和水反应的化学方程式是______。
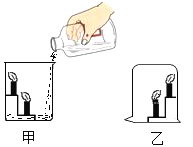
(4)老师又设计了如图所示的实验,甲烧杯中有高低不同两支燃烧的蜡烛,向甲中加入适量碳酸钠和盐酸,将乙烧杯倒扣在高低两支蜡烛上方,请你帮忙分析两实验的现象有何区别:__。
【答案】氧气 放出 钠元素和氢元素 2Na2O2+2H2O=4NaOH+O2↑ 甲中较低的蜡烛先熄灭,乙中较高的蜡烛先熄灭
【解析】
(1)过氧化钠与水反应生成了支持燃烧的氧气。同时释放出大量的热量,使温度达到可燃物的着火点。
(2)反应物是Na2O2和水,一种生成物是氧气,故另一种生成物中一定含有钠元素和氢元素。
(3)过氧化钠和水反应生成氢氧化钠和氧气, 反应的方程式为:2Na2O2+2H2O=4NaOH+O2↑.
(4)甲中的碳酸钠与稀盐酸反应生成了二氧化碳气体,二氧化碳气体不燃烧,不支持燃烧,密度比空气的密度大,故甲中较低的蜡烛先熄灭;乙中烧杯的容积较小,产生的热的二氧化碳气体上升后自上而下盖在烧杯中,故较高的蜡烛先熄灭。

 名校课堂系列答案
名校课堂系列答案【题目】一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:
纯净物 | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 2.3 | 4 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 2.2 | 2.7 | 待测 |
A.反应后X的质量为1.5g B.X中一定含有碳元素和氧元素
C.X中一定含有碳元素和氢元素 D.X中两种元素的质量比是1:1