题目内容
【题目】构成物质的粒子之间的关系如图所示。
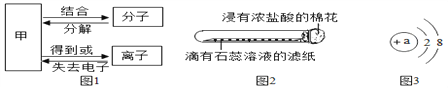
(1)甲是__________;
(2)氧气、汞和氯化钾3种物质中,由离子构成的是__________;
(3)如图2所示,将滴有石蕊溶液的滤纸放入试管中,试管口放置一浸有浓盐酸的棉花,可观察到的现象是滤纸从右到左变____色, 此现象说明分子具有的性质是___________________;
(4)图3为某粒子的结构示意图,①当a=___时,该粒子是原子;②当a=13时,该粒子的符号为_________。
【答案】 原子 氯化钾(或KCl) 红 分子是不断运动的 10 Al3+
【解析】(1)分子是由原子构成的,分子可以分解成原子;原子得失电子形成离子,故甲是原子;(2)氧气是由氧分子构成的,汞是由汞原子构成的,氯化钾是由钾离子和氯离子构成的;(3)浓盐酸呈酸性,能使紫色的石蕊试液变成红色。由于分子在不断的运动,故能观察到滤纸从右到左变红色;(4)在原子中,质子数=核外电子数,故若该粒子是原子,那么a=2+8=10;当a=13时,质子数>核外电子数,该粒子失去了3个电子,形成的是带3个单位正电荷的铝离子。根据离子的表示方法:在表示该离子的元素符号或原子团的右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略,故铝离子表示为Al3+。

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目