题目内容
氢化钙(CaH2)是一种重要的制氢剂,与水接触时发生如下反应:
CaH2+2H2O=Ca(OH)2+2H2↑.若要制得2g氢气,需CaH2的质量为多少?
【答案】
21g
【解析】
试题分析:设需要CaH2的质量为x.
CaH2+2H2O=Ca(OH)2+2H2↑
42 4
x 2g
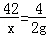
解之得:x=21g
答:需要CaH2的质量为21g.
考点:根据化学反应方程式的计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目