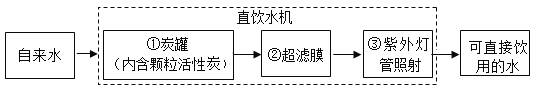
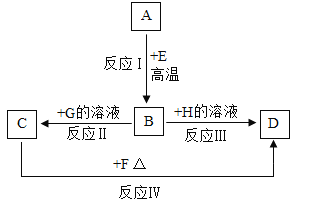
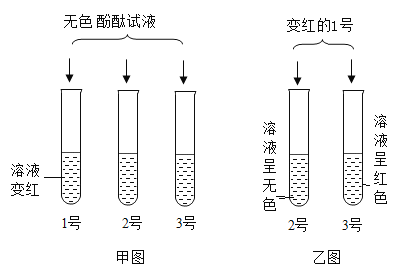
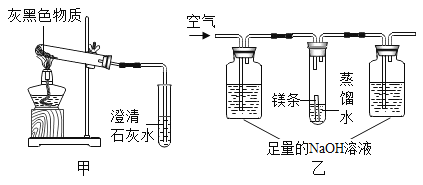
题目内容
【题目】利用如图所示的实验探究物质的性质,下列叙述错误的是()
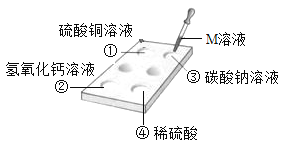
A.若②溶液变红,则M可能为酚酞溶液
B.若只有③有气泡产生,则M可能为稀盐酸
C.若①有蓝色沉淀生成,则M可能为氢氧化钡溶液
D.若①②③④都没有现象,则M可能为氢氧化钠溶液
【答案】D
【解析】
A、若②氢氧化钙溶液变红,氢氧化钙显碱性,与酚酞变红,则M可能为酚酞溶液;故选项正确,但不符合题意;
B、若只有③碳酸钠溶液有气泡产生,碳酸钠与稀盐酸反应产生二氧化碳气体,则M可能为稀盐酸;故选项正确,但不符合题意;
C、若①硫酸铜溶液有蓝色沉淀生成,硫酸铜与氢氧化钡产生氢氧化铜蓝色沉淀,则M可能为氢氧化钡溶液;故选项正确,但不符合题意;
D、若①②③④都没有现象,则M不可能为氢氧化钠溶液,氢氧化钠与①硫酸铜溶液反应产生氢氧化铜蓝色沉淀;故选项错误,但符合题意;
故选:D。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】某同学从山上采集到一种石灰石,他取160g该样品进行煅烧实验(反应化学方程式为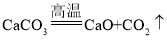 , 样品中杂质不参加反应),测得反应后固体的质量(m)与反应时间(t) 的关系如表:
, 样品中杂质不参加反应),测得反应后固体的质量(m)与反应时间(t) 的关系如表:
反应时间t/s | t0 | t 1 | t 2 | t 3 | t 4 | t 5 | t6 |
反应后固体的质量m/g | 160 | 150 | 140 | 132 | 124 | 116 | 116 |
请回答下列问题:
(1)生成物氧化钙中钙元素和氧元素的质量比为______________;其中钙元素的质量分数为_____ (结果保留两位小数)。
(2)t5时,该石灰石样品中CaCO3________________(填“已”或“未”)完全反应,共生成CO2的质量为________;
(3)求该石灰石中CaCO3的质量分数,写出计算过程_______________。
【题目】请参与探究金属铝和铜的活动性强弱,完成下列内容。
[设计实验]
编号 | 操作 | 现象 | 解释 |
甲 | 将表面未打磨的铝丝浸入CuSO4溶液中 | 无明显现象 | |
乙 | 将表面打磨后的铝丝浸入CuSO4溶液中 | 铝丝表面析出红色固体 | 化学方程式为:____________, |
丙 | 将表面未打磨的铝丝浸入CuCl2溶液中 | 铝丝表面析出__________色固体 |
|
(1)铝丝表面有一层氧化膜,其形成的原因是(用化学方程式表示)________________。
(2)比较实验乙和实验________________(填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
[结论与反思]
(1)据此可知金属活动性Al比Cu_______________(填“强”或 “弱”)。
(2)查阅资料得知: CuSO4 溶液中有Cu2+、SO42-、H2O三种粒子,CuCl2溶液中有Cu2+、CI-、H2O三种粒子。小明同学对实验丙的现象进行分析,你认为合理的猜想是______________。
AH2O 破坏了氧化铝薄膜
BCl- 破坏了氧化铝薄膜
CCu2+ 破坏了氧化铝薄膜
DSO42-破坏了氧化铝薄膜