题目内容
为了研究CO2的性质,需要制取并收集干燥的CO2气体.以下是老师提供的一些实验装置.请回答以下问题: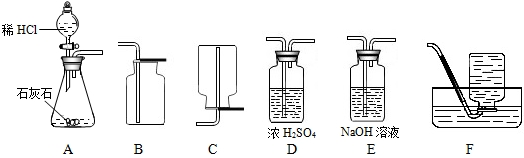
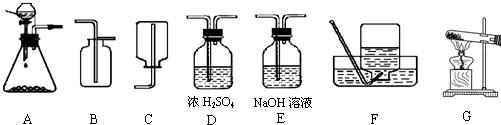
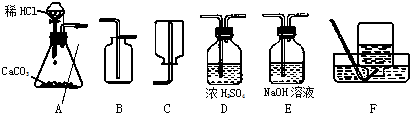
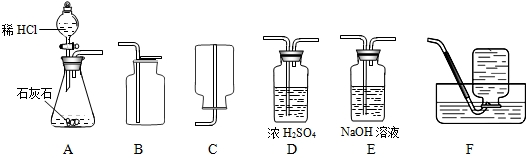
(1)制取并收集干燥的CO2气体,可采用的装置组合是
(2)实验室制取CO2的化学方程式为
(3)若实验室要制取17.6g的CO2,则需要含碳酸钙80%的石灰石的质量为
(4)若在上述实验中无法收集到预定质量的气体,则可能的原因是
分析:(1)①二氧化碳的制取:固体+液体反应,不需加热,发生装置选A;②干燥的CO2气体:用D装置,利用浓硫酸的吸水性能把气体中的水蒸气吸收而除去;③收集二氧化碳气体只能用向上排空气集气法,因为其密度比空气大,选用B装置.
(2)根据书写化学方程式的原则书写
(3)根据化学方程式,已知生成的二氧化碳的质量可求出石灰石的质量.
(4)本小题,为开放性题目,可能的原因有多种答案.
(2)根据书写化学方程式的原则书写
(3)根据化学方程式,已知生成的二氧化碳的质量可求出石灰石的质量.
(4)本小题,为开放性题目,可能的原因有多种答案.
解答:解:(1)A装置为制取装置,所用漏斗为分液漏斗,这种漏斗的优点是可以控制液体的滴加速度;干燥二氧化碳气体应该用D装置,利用浓硫酸的吸水性,不能用氢氧化钠溶液,因为NaOH溶液能和二氧化碳反应;收集二氧化碳气体只能用向上排空气集气法,因为二氧化碳气体密度比空气大,且能溶于水.
(2)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)设需含碳酸钙80%的石灰石的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑;
100 44
80%×x 1.76g
=
x=5g
答:需含碳酸钙80%的石灰石的质量为5g;
(4)实验中气体无法收集满,则可能的原因是:药品量不足或气密性不好等
故答案为:(1)A、D、B (2)CaCO3+2HCl=CaCl2+H2O+CO2↑ (3)5g;(4)药品量不足或气密性不好等
(2)碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)设需含碳酸钙80%的石灰石的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑;
100 44
80%×x 1.76g
| 100 |
| 80%×x |
| 44 |
| 1.76g |
答:需含碳酸钙80%的石灰石的质量为5g;
(4)实验中气体无法收集满,则可能的原因是:药品量不足或气密性不好等
故答案为:(1)A、D、B (2)CaCO3+2HCl=CaCl2+H2O+CO2↑ (3)5g;(4)药品量不足或气密性不好等
点评:该题为实验室制取二氧化碳的一道综合题,考查二氧化碳的实验室制法原理、制取装置、收集装置的选择,以及二氧化碳的某些性质:NaOH溶液能和二氧化碳反应.

练习册系列答案
相关题目