题目内容
(2006?下关区一模)为了研究CO2的性质,需要制取并收集干燥的CO2气体.以下是老师提供的一些实验装置.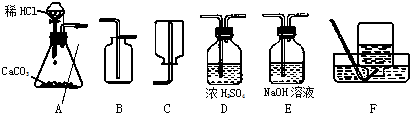
(1)制取并收集干燥的CO2气体,可采用的装置组合是
(2)实验室制取CO2的化学方程式为
(3)若在上述实验中气体无法收集满,则可能的原因是
(4)实验室制取CO2,
(5)若取11g石灰石和足量盐酸反应生成了4.4g二氧化碳(假设无损失),则此石灰石中碳酸钙的质量分数是多少?(C-12 O-16 Ca-40)

(1)制取并收集干燥的CO2气体,可采用的装置组合是
ADB
ADB
(填字母).(2)实验室制取CO2的化学方程式为
CaCO3 +2HCl═CaCl2+H2O+CO2↑
CaCO3 +2HCl═CaCl2+H2O+CO2↑
.(3)若在上述实验中气体无法收集满,则可能的原因是
药品不足、装置漏气
药品不足、装置漏气
.(4)实验室制取CO2,
不能
不能
(填“能”或“不能”)将稀HCl换成浓HCl,理由是:因为浓盐酸会挥发出大量的HCl气体使制出的气体不纯
因为浓盐酸会挥发出大量的HCl气体使制出的气体不纯
.(5)若取11g石灰石和足量盐酸反应生成了4.4g二氧化碳(假设无损失),则此石灰石中碳酸钙的质量分数是多少?(C-12 O-16 Ca-40)
分析:(1)根据实验室制取二氧化碳的反应物的状态及反应条件确定发生装置,根据二氧化碳的收集方法确定收集装置,制取的二氧化碳常用浓硫酸进行干燥;
(2)根据实验室制取二氧化碳的反应,写出反应的方程式;
(3)根据制取二氧化碳的步骤及注意事项分析;
(4)根据浓盐酸的挥发性进行分析.
(5)根据碳酸钙与盐酸反应的方程式由二氧化碳的质量求出碳酸钙的质量,再求出石灰石中碳酸钙的质量分数.
(2)根据实验室制取二氧化碳的反应,写出反应的方程式;
(3)根据制取二氧化碳的步骤及注意事项分析;
(4)根据浓盐酸的挥发性进行分析.
(5)根据碳酸钙与盐酸反应的方程式由二氧化碳的质量求出碳酸钙的质量,再求出石灰石中碳酸钙的质量分数.
解答:解:(1)实验室用大理石和稀盐酸反应制取二氧化碳,反应物的状是固体和液体,反应条件是常温,应选用发生装置A,由于二氧化碳的密度大于空气的密度,可选用收集装置B;在收集前用浓硫酸进行干燥.所以可采用的装置组合是ADB;
(2)实验室制取CO2的化学方程式为:CaCO3 +2HCl═CaCl2+H2O+CO2↑;
(3)若在上述实验中气体无法收集满,则可能的原因是药品不足、装置漏气等;
(4)实验室制取CO2,不能将稀HCl换成浓HCl,理由是:因为浓盐酸会挥发出大量的HCl气体使制出的气体不纯;
(5)设石灰石中碳酸钙的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
X 4.4g
=
解得:X=10g
石灰石中碳酸钙的质量分数是
×100%≈90.9%
故答为:(1)ADB; (2)CaCO3 +2HCl═CaCl2+H2O+CO2↑; (3)药品不足、装置漏气等;(4)不,因为浓盐酸会挥发出大量的HCl气体使制出的气体不纯;(5)石灰石中碳酸钙质量分数是90.9%.
(2)实验室制取CO2的化学方程式为:CaCO3 +2HCl═CaCl2+H2O+CO2↑;
(3)若在上述实验中气体无法收集满,则可能的原因是药品不足、装置漏气等;
(4)实验室制取CO2,不能将稀HCl换成浓HCl,理由是:因为浓盐酸会挥发出大量的HCl气体使制出的气体不纯;
(5)设石灰石中碳酸钙的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
X 4.4g
| 100 |
| 44 |
| X |
| 4.4g |
石灰石中碳酸钙的质量分数是
| 10g |
| 11g |
故答为:(1)ADB; (2)CaCO3 +2HCl═CaCl2+H2O+CO2↑; (3)药品不足、装置漏气等;(4)不,因为浓盐酸会挥发出大量的HCl气体使制出的气体不纯;(5)石灰石中碳酸钙质量分数是90.9%.
点评:该题为实验室制取二氧化碳的一道综合题,考查二氧化碳的实验室制法原理、制取装置、收集装置的选择,以及二氧化碳的某些性质:NaOH溶液能和二氧化碳反应.

练习册系列答案
相关题目
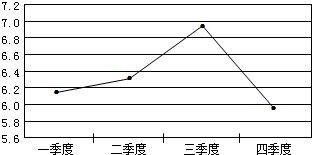 (2006?下关区一模)在一年中不同时期,对秦淮河某段检测河水的平均pH值变化,根据记录得到如图所示的折线图.那么,这一年内此段河水酸性最弱的季度是( )
(2006?下关区一模)在一年中不同时期,对秦淮河某段检测河水的平均pH值变化,根据记录得到如图所示的折线图.那么,这一年内此段河水酸性最弱的季度是( )