题目内容
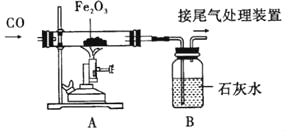
【题目】中国制造业正在持续发展, 汽车制造是重庆制造业的一个代表。请根据所学知识 按要求填空。
(1)钢铁车壳表面喷漆不仅美观,而且可有效防止与空气中的______(填两种物质名称)接触而生锈。
(2)汽车制造需要钢铁,工业上用赤铁矿(主要成分为氧化铁)与一氧化碳来炼铁的化学方方程式为___,该反应中_____(填化学式)发生了氧化反应。
(3)下列汽车组件中,由有机合成材料制成的是_____(填序号)。
A 钢铁车架 B 真皮座套 C 玻璃车窗 D 橡胶轮胎
【答案】氧气、水 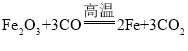
![]() D
D
【解析】
金属生锈条件:有水、有氧气;材料分为金属材料、合成材料、无机非金属材料、复合材料;一氧化碳和氧化铁反应生成铁和二氧化碳,一氧化碳是还原剂,被氧化,氧化铁是氧化剂,被还原,有机合成材料有合成纤维、合成橡胶、塑料。
(1) 金属生锈条件:有水、有氧气,钢铁车壳表面喷漆不仅美观,而且可有效防止与空气中的氧气和水接触而生锈。
(2)汽车制造需要钢铁,工业上用赤铁矿(主要成分为氧化铁)与一氧化碳来炼铁,一氧化碳和氧化铁反应生成铁和二氧化碳,化学方方程式为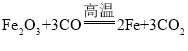 ,一氧化碳是还原剂,被氧化,氧化铁是氧化剂,被还原,反应中一氧化碳发生了氧化反应,化学式为
,一氧化碳是还原剂,被氧化,氧化铁是氧化剂,被还原,反应中一氧化碳发生了氧化反应,化学式为![]() 。
。
(3) A、钢铁车架是由合金制成是,属于金属材料,故A不正确;
B、真皮座套属于天然材料,故B不正确;
C、玻璃车窗是由玻璃制成的,属于无机非金属材料,故C不正确;
D、有机合成材料有合成纤维、合成橡胶、塑料,有机合成材料制成的是橡胶轮胎,故选D。

【题目】碘化钾(KI)是白色固体,保存不当会被氧化为单质碘(I2)而泛黄变质。实验小组为探究碘化钾变质原理,进行如下活动。
(查阅资料)
I.对于碘化钾变质的原理,有两种不同的反应:
甲:4KI+O2+2CO2==2K2CO3+2I2乙:4KI+O2+2X=4KOH+2I2
⑴请将上述方程式补充完整,X的化学式是_____。
Ⅱ.KOH与NaOH都属于碱,二者的化学性质相似。
(进行实验)实验1:探究变质的原理
取适量碘化钾固体暴露于空气一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
⑵实验过程中产生的气体是_____。化学小组认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是_____。
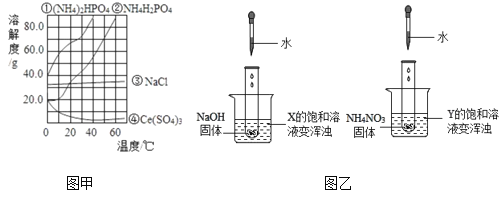
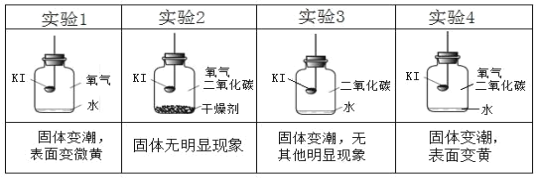
(进行实验)实验2:探究变质的条件
分别取适量KI于燃烧匙中,再分别放入盛有不同物质的集气瓶中,塞紧胶塞,若干天后观察。
(解释与结论)
⑶对比实验_____(填序号),可以得出KI变质一定与水有关。对比实验_____(填序号),可以得出KI变质一定与氧气有关。
⑷从上述实验可推知,KI变质的条件是_____。
(提出问题)CO2的作用是什么?
(进行实验)
分别取10mL同浓度的KI溶液于3支试管中(试管编号1,2,3),再向试管2中通入CO2,向试管3中滴加几滴盐酸,分别用pH试纸测定溶液的pH;几分钟后,观察溶液的颜色。实验现象记录如下:
试管序号 | 1 | 2 | 3 |
溶液pH | pH=8 | pH=6 | pH=4 |
溶液颜色 | 无色 | 浅黄色 | 黄色 |
(解释与结论)
⑸①pH试纸的使用方法是_____。②CO2在KI变质过程中的作用是_____。
(反思与评价)
⑹探究KI变质条件时,同学们排除了氮气和稀有气体的影响,其原因是_____。
(拓展应用)
测定实验中使用的盐酸中所含溶质的质量分数。
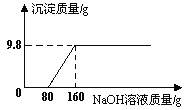
⑺向烧杯中加入质量分数为10%的氢氧化钠溶液40g,再逐滴加入该盐酸,用pH计测定滴加过程中溶液的pH值。图2为滴加盐酸的质量与溶液pH的关系图。
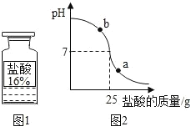
①a点对应的溶液中的溶质为_____(写化学式)。
②盐酸与氢氧化钠溶液反应是_____(选填“吸热”或“放热”)反应。
请以此次测定的数据,列式计算该盐酸的实际溶质质量分数。_____(写出计算过程)
⑻该盐酸的实际溶质质量分数与标签上标出的溶质质量分数不同的可能原因:_____(不考虑测量误差)。
【题目】维生素C(简称Vc,又名抗坏血酸)易溶于水,水溶液呈酸性,易被O2、I2(碘)氧化。某同学为了探究Vc的性质,进行了如下实验。
实验1:用某制药厂生产的Vc片(每片含Vc0.1g及不溶性辅料)配制0.5%的Vc溶液。
(1)若取5片Vc片,应大约取蒸馏水____mL(取整数)
(2)量取蒸馏水除了用到量筒外还需用到的仪器是_____。
实验2:设计实验证明 Vc 溶液具有酸性。
(3)限用试剂:无色酚酞溶液、稀氢氧化钠溶液。请你完成下表。
实验步骤 | 预期现象及结论 |
_______ | _______,说明Vc溶液具有酸性 |
实验3:探究Vc溶液在一定温度下(18℃)露置时间对Vc含量的影响,采用控制变量法进
行实验,具体如下表所示。 (信息提示:淀粉与碘作用显蓝色。往碘水中加入几滴淀粉溶液,然后逐滴加入Vc溶液,当溶液的蓝色褪去,说明碘与Vc恰好完全反应。)
实验 序号 | 碘水浓度 及用量 | 淀粉溶液 | Vc 溶液恒温露置时间/h | 蓝色消失需要 Vc 溶液滴数 |
① | 0.06%、4.8mL | 3 滴 | 0 | 10 |
② | 0.06%、4.8mL | 3 滴 | 12 | 12 |
③ | 3 滴 | 24 | 18 | |
④ | 0.06%、4.8mL | 3 滴 | 36 |
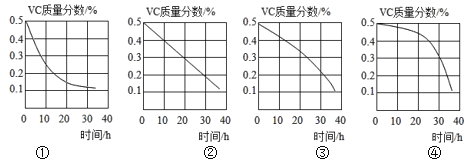
(4)实验③中碘水浓度及用量分别是_____。
(5)Vc质量分数随露置时间(0~36h)的变化图像,正确的是____(填图像标号)。
(6)为了提高定量探究Vc溶液的准确性,配制Vc溶液时,必须先除去溶解在蒸馏水中的少量O2,具体处理方法是_____。