题目内容
长期使用的热水壶底部有一层水垢,主要成分是碳酸钙和氢氧化镁,用稀盐酸可以清除水垢.某学校化学研究性学习小组的同学通过实验测定水垢中碳酸钙的含量:将过量的稀盐酸加入到400g水垢中,把产生的CO2气体用足量的NaOH溶液吸收,同时测量3分钟内NaOH溶液增加的质量,结果如表所示:
| 时间/s | 0 | 30 | 60 | 90 | 120 | 150 | 180 |
| 增加的质量/g | 0 | 60 | 100 | 120 | 132 | 132 | 132 |

(2)从表中看出:NaOH溶液质量增加132g后,质量不再增加,表明______.计算水垢中碳酸钙的质量分数.(写出简单的计算过程)
解:(1)氢氧化钠因吸收二氧化碳而质量增加,根据生成中氢氧化钠溶液质量的增加和反应时间确定点,把点用平滑曲线连接;
故答案为:

二氧化碳与氢氧化钠反应生成碳酸钠和水;
故选CO2+2NaOH═Na2CO3+H2O;
(2)NaOH溶液质量不再增加,说明不再有二氧化碳气体放出,即水垢已完全反应;
故答案为:400g水垢与盐酸反应生成的CO2最多是132g;
设水垢中碳酸钙的质量为x
CaCO3~CO2
100 44
x 132g
100:44=x:132g 解之得 x=300g
水垢中碳酸钙的质量分数= ×100%=75%
×100%=75%
故答案为:75%
分析:(1)根据实验数据绘制溶液增加量与反应时间关系的曲线图;
(2)判断反应的进行情况,利用反应的化学方程式计算样品中碳酸钙质量,求出试样中碳酸钙的质量分数.
点评:吸收二氧化碳通常采用氢氧化钠溶液,而检验二氧化碳一般使用氢氧化钙溶液.
故答案为:

二氧化碳与氢氧化钠反应生成碳酸钠和水;
故选CO2+2NaOH═Na2CO3+H2O;
(2)NaOH溶液质量不再增加,说明不再有二氧化碳气体放出,即水垢已完全反应;
故答案为:400g水垢与盐酸反应生成的CO2最多是132g;
设水垢中碳酸钙的质量为x
CaCO3~CO2
100 44
x 132g
100:44=x:132g 解之得 x=300g
水垢中碳酸钙的质量分数=
 ×100%=75%
×100%=75%故答案为:75%
分析:(1)根据实验数据绘制溶液增加量与反应时间关系的曲线图;
(2)判断反应的进行情况,利用反应的化学方程式计算样品中碳酸钙质量,求出试样中碳酸钙的质量分数.
点评:吸收二氧化碳通常采用氢氧化钠溶液,而检验二氧化碳一般使用氢氧化钙溶液.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
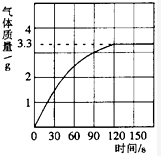 某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到10g水垢中,产生CO2气体的情况如图所示.
某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到10g水垢中,产生CO2气体的情况如图所示.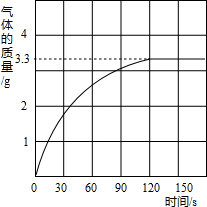 某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到10g水垢中,产生CO2气体的情况如图所示.
某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到10g水垢中,产生CO2气体的情况如图所示.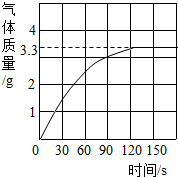 某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙.他们为了测定水垢中碳酸钙的含量,将足量盐酸加入到12.5g水垢中,产生CO2气体的情况如图所示.
某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙.他们为了测定水垢中碳酸钙的含量,将足量盐酸加入到12.5g水垢中,产生CO2气体的情况如图所示.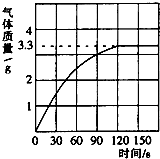 某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生CO2气体的情况如图所示.
某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢中,产生CO2气体的情况如图所示.