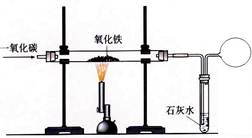
题目内容
钢铁是使用最多的金属材料。
(1)铁制品在一定条件下能生锈,疏松的铁锈不能阻碍里层的铁继续与 反应,因此铁制品可以进一步锈蚀。防止自行车链条生锈的合理措施是 。用盐酸除铁锈的化学方程式为 。
(2)用一氧化碳和赤铁矿炼铁的化学方程式为 。回收利用废旧金属制品的目的之一是 。
⑴水和氧气 涂油 Fe2O3+6HCl==2FeCl3+3H2O
⑵Fe2O3+3CO高温2Fe+3CO2 节约有限的金属资源
解析试题分析:铁在与氧气和水共同作用时易生锈,防止铁的锈蚀可采取的措施,保持铁制品表面清洁干燥或建立保护层,防止自行车链条生锈的合理措施可采取的措施是涂油;利用酸能和金属氧化物反应生成盐和水,可利用稀盐酸除锈,反应原理为Fe2O3+6HCl==2FeCl3+3H2O,高炉炼铁的反应原理为Fe2O3+3CO高温2Fe+3CO2 ,回收利用废旧金属制品的主要目的是节约金属资源。
考点:金属的锈蚀与防护;金属的冶炼

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
某同学用如图所示装置模拟炼铁化学原理,他的操作及观察到现象正确的是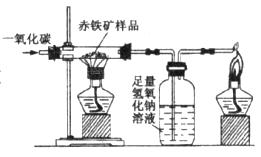
| A.反应前先加热再通入一氧化碳 |
| B.将反应后的气体通入氢氧化钠溶液目的是证明有二氧化碳生成 |
| C.黑色赤铁矿粉末逐渐变为红色 |
| D.用酒精灯点燃尾气,防止一氧化碳污染空气 |
世界每年因腐蚀而报废的金属设备和材料相当于年产量的20% ~ 40% ,为探究铁锈蚀条件,某同学设计的实验如图所示,一周后观察到_______(填序号)试管内的铁钉生锈。请分析铁生锈的条件及防锈措施。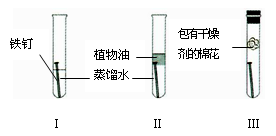
(7分)使用密度小、强度大的镁合金能减轻汽车自重,从而减少汽油消耗和废气排放。
|
(3)制镁的原料MgO可从海水中获得。小华利用镁与盐酸反应后的废液,模拟从海水中获取MgO的过程,实验如下:
步骤1:向上述废液中,边搅拌边分批加入CaO,至MgCl2完全沉淀为止,过滤得Mg(OH)2固体。共消耗8.4g CaO。
步骤2:将Mg(OH)2固体加热分解为MgO和水,所得MgO的质量为4.0g 。
①步骤2中Mg(OH)2分解的化学方程式为 。
②通过所得MgO的质量计算上述废液中含MgCl2的质量m= g。
③分析实验数据,可知步骤Ⅰ中反生的化学反应有:
CaO+H2O==Ca(OH)2;Ca(OH)2+MgCl2==CaCl2+Mg(OH)2↓; 。
在反应:3CO+Fe2O3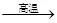 2Fe+3CO2中,还原剂是
2Fe+3CO2中,还原剂是
| A.CO | B.Fe2O3 | C.Fe | D.CO2 |