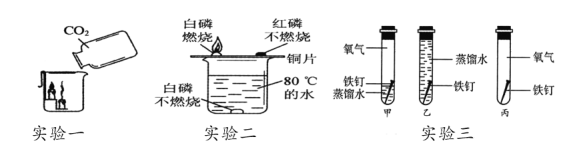
题目内容
【题目】取氯化钠和碳酸钠的混合物10.6克于烧杯中,完全溶解于一定量的水中,向所得溶液中滴加10%的稀盐酸,所加稀盐酸与生成气体质量如图所示,求:

(1)写出图中A点表示的溶质的化学式_______。
(2)图中BC段表示的意义是________。
(3)原混合物中碳酸钠的质量分数____________
【答案】NaCl 、Na2 CO3 盐酸过量 50%
【解析】
(1)向氯化钠和碳酸钠的混合溶液中滴加盐酸,盐酸与碳酸钠反应生成氯化钠、水和二氧化碳,所以图中A点表示碳酸钠没有反应完毕,所以A点中的溶质有氯化钠、碳酸钠,化学式分别为:NaCl、Na2CO3;
(2)向氯化钠和碳酸钠的混合溶液中滴加盐酸,盐酸与碳酸钠反应生成氯化钠、水和二氧化碳,碳酸钠反应完毕后二氧化碳的质量不再改变,所以图中BC段表示的意义是碳酸钠反应完毕后二氧化碳的质量不再改变即盐酸过量;
(3)分析图像中的信息可以知道当生成的气体达到2.2g后,气体的质量不再增加,所以可以判断生成气体的最大值为2.2g。
设:生成2.2克二氧化碳,需要碳酸钠的质量为x。

![]() 解得:x=5.3g;
解得:x=5.3g;
原混合物中碳酸钠的质量分数=![]() 。
。

练习册系列答案
相关题目