题目内容
【题目】在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应。请与他们一起完成实验方案的设计、实施和评价。
(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃)
①将pH试纸伸入某NaOH溶液中,测定NaOH溶液的pH,pH_____7(选填“大于”、“等于”或“小于”);实验操作中的错误是_____。
②将一定量的稀H2SO4加入该NaOH溶液中,混合均匀后测定其pH,pH小于7。
结论:稀H2SO4与NaOH溶液发生了化学反应,并且_____(填写溶质的化学式)过量。
(2)方案二:向盛有NaOH溶液的烧杯中先滴加酚酞试液,后滴加稀硫酸至过量,观察到_____的现象。
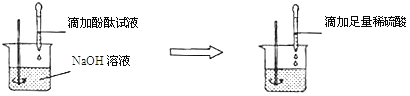
结论:稀H2SO4与NaOH溶液发生了化学反应,反应的化学方程式为_____。
(3)上述两个方案在设计思想上的相同点是_____。
(4)为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是_____(选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度_____次。
(5)实验室存放的常见的碱除了氢氧化钠外,还有氢氧化钙,它们存放时都需密封保存,请用化学方程式解释澄清的石灰水必须密封保存的原因_____。
【答案】大于 将pH试纸伸入NaOH溶液 H2SO4 溶液由红色变成无色 2NaOH+H2SO4=Na2SO4+2H2O 采用了间接观察的方法 放热 3 CO2+Ca(OH)2=CaCO3↓+H2O
【解析】
(1)①氢氧化钠溶液呈碱性,其pH大于7,测定溶液的pH时,不能将pH试纸伸入待测溶液中,以免造成试剂污染。②硫酸呈酸性,其pH小于7;将一定量的稀H2SO4加入该NaOH溶液中,混合均匀后测定其pH,pH小于7,说明稀H2SO4与NaOH溶液发生了化学反应,并且硫酸过量。
(2)氢氧化钠溶液呈碱性,酚酞遇碱性溶液变红,无色的酚酞试液在酸性溶液与中性溶液中均不变色,所以向盛有NaOH溶液的烧杯中先滴加酚酞试液,后滴加稀硫酸至过量,此时溶液显酸性,可观察到溶液由红色变成无色。硫酸与氢氧化钠反应生成硫酸钠和水,2NaOH+H2SO4=Na2SO4+2H2O;
(3)上述两个方案在设计思想上的相同点是采用了间接观察的方法。
(4)中和反应为放热反应,可以通过测定反应前后溶液的温度变化来进行确定,反应前测定起始温度,反应中测定温度是否升高,加入过量的硫酸再测定溶液的温度是否降低,故最少需要测定3次。
(5)澄清的石灰水是氢氧化钙溶液,氢氧化钙能与空气中的二氧化碳反应生成碳酸钙白色沉淀和水,CO2+Ca(OH)2=CaCO3↓+H2O。

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案