题目内容
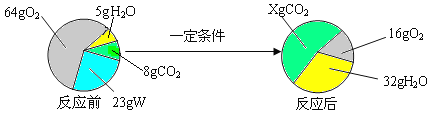
【题目】某同学在实验室发现一瓶标签残缺(如图所示)的溶液.为了测定此溶液的溶质质量分数,他取出![]() 该溶液,向其中逐滴加入溶质质量分数为
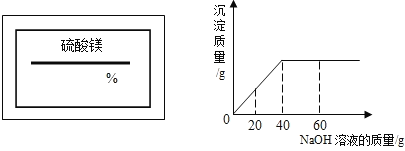
该溶液,向其中逐滴加入溶质质量分数为![]() 的NaOH溶液.反应过程中生成沉淀的质量与所用NaOH溶液质量的关系如图所示.请计算此溶液的溶质质量分数.
的NaOH溶液.反应过程中生成沉淀的质量与所用NaOH溶液质量的关系如图所示.请计算此溶液的溶质质量分数.
【答案】24%
【解析】
标签上可以看出该溶液是硫酸镁溶液,向硫酸镁溶液中加入氢氧化钠溶液会发生如下反应:MgSO4+2NaOH=Na2SO4+Mg(OH)2↓。但必须注意的是,参加反应的只是溶液中的溶质,而溶剂水是不参加反应的。我们再来看看关系图,发现:当加入NaOH溶液的质量是40g时,两者恰好完全反应。则参加反应的NaOH的质量是(注意参加两个字)40g×10%,由参加反应的NaOH的质量就可以求出参加反应的硫酸镁的质量(即硫酸镁溶液中溶质的质量)。
解:反应恰好完成时所用NaOH的质量:40g×10%=4g
设25g硫酸镁溶液中溶质的质量为x
MgSO4+2NaOH=Na2SO4+Mg(OH)2↓
120 80
x 4g
![]()
x=6g
硫酸镁溶液中溶质质量分数为:![]() ×100%=24%,
×100%=24%,
答:该硫酸镁溶液中溶质质量分数为24%。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目