题目内容
【题目】某化学兴趣小组利用氧化铜、稀硫酸、氢氧化钠溶液制备氢氧化铜。在实验过程中小组同学发现了一些“异常现象”,并没有成功制得氢氧化铜。请你一起参与小组分析讨论,并回答下列相关问题:
实验原理:CuO ![]() CuSO4
CuSO4 ![]() Cu(OH)2
Cu(OH)2
转化①的化学反应方程式为_____;转化②的化学反应方程式为_____。
查阅资料:(1)硫酸铜溶液显酸性
(2)可采用加热的方法,加快氧化铜和稀硫酸的反应速度
(3)氢氧化铜的热稳定性较差,温度高于80℃时,会分解成氧化铜和水
异常现象一:最终什么沉淀都没有,只得到蓝色液体
异常现象二:刚开始有蓝色沉淀出现,但一会儿后部分沉淀变成黑色
异常现象三:试管中黑色固体一直未消失,并没有出现蓝色液体,更没有蓝色沉淀
交流与讨论一:
针对异常现象一:小明认为蓝色液体中除含有硫酸铜,还可能含有的溶质是_____(化学式)。
实验验证:
(1)小华认为只需加入紫色石蕊试液,即可判断。其他同学一致反对,其原因是_____。
(2)为了不影响氢氧化铜的制备,你认为可向蓝色溶液中加入_____检验(填序号)。
A 氧化铜 B 酚酞试液 C 氯化钡溶液 D 铝粉
交流与讨论二:
针对异常现象二:小华查阅资料后找到了原因,你认为可能是因为_____;部分沉淀变成黑色时,发生反应的化学方程式为_____。
交流与讨论三:
针对异常现象三:小芳剖析实验过程,认为形成这一异常现象的原因可能是在氧化铜中先加入了_____(化学式)试剂。
反思与小结:在验证盐酸与氢氧化钠能发生反应时,需用到酚酞试液。其实也可以不用指示剂,先在氢氧化钠溶液中加入_____,再滴加稀盐酸。如观察到_____现象时,也能证明它们发生了反应。
【答案】CuO+H2SO4=CuSO4+H2O 2NaOH+CuSO4=Na2SO4+Cu(OH)2↓ H2SO4 硫酸铜溶液显酸性也能使紫色石蕊试液变红 A 实验过程中加热,溶液的温度达到80℃以上,部分沉淀分解 ![]() 氢氧化钠溶液 氧化铜 溶液不变蓝
氢氧化钠溶液 氧化铜 溶液不变蓝
【解析】
由金属氧化物得到盐就可以加酸,氧化铜和稀硫酸反应生成硫酸铜和水,方程式为:CuO+H2SO4=CuSO4+H2O;要将硫酸铜变为氢氧化铜,可以引入可溶性碱,如氢氧化钠,氢氧化钠和硫酸铜反应生成氢氧化铜蓝色沉淀和硫酸钠,方程式为:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
交流与讨论一:根据氧化铜和稀硫酸反应生成硫酸铜和水,不知道物质是否过量,因此反应后溶液中除了硫酸铜还可能存在稀硫酸;
(1)加入紫色石蕊试液不能判断溶液中是否含有稀硫酸,因为硫酸铜溶液是酸性的;
(2)根据酸的化学性质,可以继续加入氧化铜进行验证;
交流与讨论二:
刚开始有蓝色沉淀出现,但一会儿后部分沉淀变成黑色;可能是因为实验过程中加热,溶液的温度达到80℃以上,部分沉淀分解;部分沉淀变成黑色时,是因为氢氧化铜在高温时分解生产氧化铜和水,方程式为![]() ;
;
试管中黑色固体一直未消失,并没有出现蓝色液体,更没有蓝色沉淀,可能是在开始的氧化铜中加入氢氧化钠溶液,加入的稀硫酸和氢氧化钠反应,氧化铜一直没有反应。
根据题中的现象,可以在氢氧化钠溶液中加入氧化铜,进行验证盐酸和氢氧化钠的反应,盐酸可以和氧化铜反应生成氯化铜蓝色溶液,若没有蓝色溶液则盐酸和氢氧化钠发生了反应。
故答案为:(1)实验原理:CuO+H2SO4=CuSO4+H2O;
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓;
交流与讨论一:H2SO4;
(1)硫酸铜溶液显酸性也能使紫色石蕊试液变红;(2)A;
交流与讨论二:实验过程中加热,溶液的温度达到80℃以上,部分沉淀分解;
![]() ;
;
交流与讨论三:氢氧化钠溶液;
反思与小结:氧化铜 溶液不变蓝 (其他合理答案也可)。

【题目】K2CO3和KNO3在不同温度时的溶解度及溶解度曲线如图所示。下列说法错误的是( )
温度/℃ | 20 | 30 | 50 | 60 | 80 | |
溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
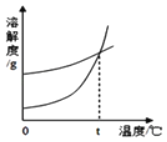
A. t℃在60℃~80℃之间
B. t℃时,两物质溶液的溶质质量分数可能相等
C. 30℃时,K2CO3的溶解度大于KNO3的溶解度
D. 将60℃时的105 g饱和KNO3溶液降温至20℃,析出的晶体质量为78.4 g