题目内容
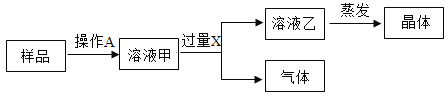
【题目】复分解反应的实质就是酸碱盐解离出一些阴、阳离子相互结合生成难解离的水、气体或沉淀,根据下列部分碱盐的溶解性表 20℃,回答下列问题:

(1)H2SO4 在水中能解离出的离子是________(填离子符号);
(2)向稀硫酸中滴入氢氧化钡溶液的化学反应方程式为________,该反应前后溶 液中数目发生变化的阴阳离子是________(填离子符号);
(3)根据溶解性表及复分解反应的实质判断,将“硫酸、氯化钡、氢氧化钠、碳酸钾”四种物质的溶液两两混合,能发生的反应有________个.
【答案】H+ SO42- H2SO4+Ba(OH)2═BaSO4↓+2H2O Ba2+、H+、OH-、SO42- 4
【解析】
(1)H2SO4在水中会解离出氢离子和硫酸根离子,两种离子的符号分别为H+ SO42-;
(2)硫酸和氢氧化钡反应生成物是硫酸钡和水,用观察法配平即可,所以方程式是:H2SO4+Ba(OH)2═BaSO4↓+2H2O;该反应前后溶液中数目发生变化的阴.阳离子是:H+、Ba2+SO42- OH-;
(3)硫酸与氯化钡可产生硫酸钡沉淀、与氢氧化钠可形成水、与碳酸钾可生成水与二氧化碳,氯化钡与碳酸钠可形成碳酸钡沉淀,符合复分解反应产生水或气体或沉淀的发生条件,而氯化钡与氢氧化钠、氢氧化钠与碳酸钠因不能形成气体、水或沉淀而不能发生复分解反应,因此“硫酸、氯化钡、氢氧化钠、碳酸钾”四种 物质的溶液两两混合,共能发生 4 个反应.

 阅读快车系列答案
阅读快车系列答案【题目】为研究化学反应前后反应物与生成物之间的质量关系,做了下列三个实验。
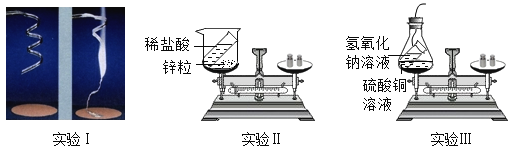
实验Ⅰ:称量镁条,点燃,待反应结束后,再称量。实验Ⅱ:将盛有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将稀盐酸与锌粒接触,过一会儿再称量。实验Ⅲ:将装有氢氧化钠溶液的试管放入盛有硫酸铜溶液的烧杯中,称量,然后设法将两种溶液接触(有蓝色氢氧化铜沉淀和硫酸钠生成),过一会儿再称量。数据见下表:
编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应前 | 4.8g | 112.6g | 118.4g |
反应后 | 6.0g | 112.4g | 118.4g |
(1)从表面上看,这三个实验中,发生化学反应前后物质的质量:实验Ⅰ_____;实验Ⅱ_____;实验Ⅲ_____。(填“增大”、“减小”或“不变”)
(2)造成此结果的原因可能是_____。
(3)这三个实验中,实验_____正确地反映了反应物与生成物之间的质量关系。
(4)从不能正确反映反应物与生成物之间质量关系的实验中,选一例说明实验设计的不恰当之处,并提出改进思路:_____。
(5)由此可得出,在做实验研究化学反应前后反应物与生成物之间的质量关系时,必须在_____体系中进行。
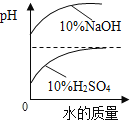
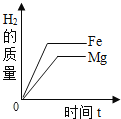
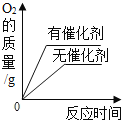
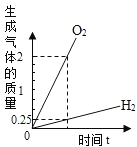
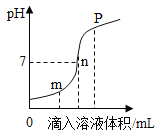
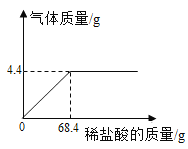
【题目】下列图象能正确反映对应变化关系的是 ( )
|
|
|
|
A.稀释10%的NaOH和10% 的 H2SO4 | B.将等质量的镁片和铁片投入到足量稀H2SO4中 | C.用等质量、等浓度的双氧水分别制取氧气 | D.将水通电一段时间 |
A. A B. B C. C D. D