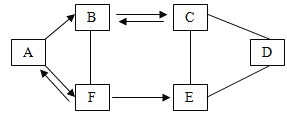
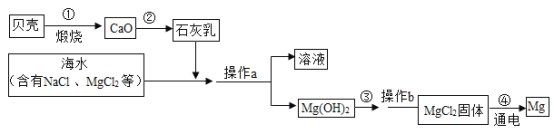
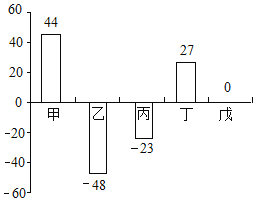
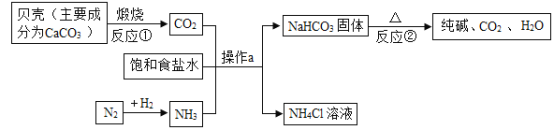
题目内容
【题目】如图表示稀盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化,请回答下列问题:
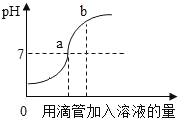
(1)由图可知该实验操作是将_____滴加到另一种溶液中.
(2)所发生中和反应的化学方程式_____.
(3)曲线上b点所含的离子是_____(用符号表示).
(4)下列实际应用中,没有利用中和反应原理的是_____
A 服用含氢氧化铝的药物,可以治疗胃酸过多症
B 用氢氧化钠溶液洗涤石油产品中的残留硫酸
C 用生石灰作干燥剂
【答案】氢氧化钠溶液 NaOH+HCl=NaCl+H2O Na+、Cl﹣、OH﹣ C
【解析】
(1)由图可知起点处pH小于7,随着溶液的加入,溶液的pH由小于7变化为大于7,所以原溶液为稀盐酸,加入的为溶液为氢氧化钠溶液;
(2)反应是盐酸和氢氧化钠反应生成氯化钠和水,对应的化学方程式为![]() ;
;
(3)b点是氢氧化钠过量,所以溶液中有生成的氯化钠和剩余的氢氧化钠,溶液中的离子为![]() 、
、![]() 、
、![]() ;
;
(4)中和反应是酸和碱反应生成盐和水的反应,则有:
A、服用含氢氧化铝的药物,可以治疗胃酸过多症,难溶性碱氢氧化铝和盐酸反应生成氯化铝和水,是中和反应,A选项不正确,不符合题意;
B、用氢氧化钠溶液洗涤石油产品中的残留硫酸,氢氧化钠与硫酸反应生成硫酸钠和水,是中和反应,B选项不正确,不符合题意;
C、用生石灰作干燥剂,是氧化钙和水的反应,生成氢氧化钙,不是中和反应,C选项正确,符合题意。故选C。

【题目】为测定锌铜合金中锌的含量,取该合金放入如图 14 盛有稀硫酸的锥形瓶中,发生反应: Zn+H2SO4=ZnSO4+H2↑ 。多次实验后,取平均值所得数据如下表:

反应前 | 充分反应后装置及反应剩余物质质量 | |
装置和足量的稀硫酸质量 | 锌铜合金质量 | |
342.10g | 16.00g | 357.70g |
若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)根据质量守恒定律求生成氢气的质量。
(2)该合金中锌的质量分数。