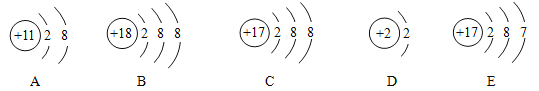
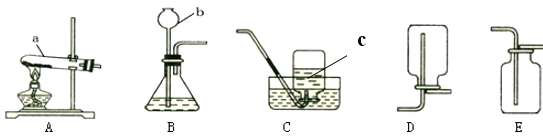
题目内容
【题目】某氯化钠样品中含有少量碳酸钠杂质,为除去碳酸钠杂质,按如下流程进行试验:
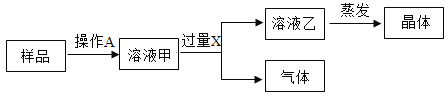
请回答:
(1)操作A中,玻璃棒的作用是___________。
(2)加入过量X时,产生的气体为_________。
(3)该过程中,蒸发的目的是___________。
【答案】加速溶解 CO2 使氯化钠溶液中水分消失,而得到氯化钠晶体
【解析】
(1)氯化钠样品中含有少量碳酸钠杂质,氯化钠和碳酸钠都溶于水,样品溶解为溶液甲,溶解过程中需要用玻璃棒加速溶解,故填写:加速溶解;
(2)氯化钠中混有碳酸钠,除去碳酸钠用过量的稀盐酸,稀盐酸与碳酸钠反应生成氯化钠、水、二氧化碳,因此,加入过量X时,产生的气体为二氧化碳,故填写:CO2;
(3)溶液乙为氯化钠溶液蒸发得氯化钠晶体,该过程中,蒸发的目的是使氯化钠溶液中水分消失,而得到氯化钠晶体,故填写:使氯化钠溶液中水分消失,而得到氯化钠晶体。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
【题目】以下是某研究小组探究影响化学反应速率快慢的一些因素的相关数据(常温通常指20℃;“浓度”指溶质的质量分数)
实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液质量/g | 温度/℃ | 二氧化锰用量/g | 氧气体积/ml | 反应所需时间/s |
① | 5 | 12 | 20 | 0.2 | 125 | 11 |
② | 30 | 12 | 20 | 0.2 | 125 | 2 |
③ | 30 | 12 | 40 | / | 125 | 148 |
④ | 30 | 12 | 90 | / | 125 | 82 |
(1)通过实验①和②对比可知,化学反应快慢与_____有关;
(2)通过对比实验_____和_____可知(填序号),化学反应快慢与温度的关系是_____。
(3)由上述实验可知,实验室用过氧化氢制取氧气的最合适的条件是_____。
(4)写出该反应的化学方程式_____。