题目内容
【题目】某化学学习小组通过实验探究分子的性质.
(1)【查阅资料】氨气溶于水形成氨水,氯化氢气体溶于水形成盐酸;浓氨水和浓盐酸都具有很强的挥发性.
【实验准备】向盛有约20mL蒸馏水的小烧杯A中加入5~6滴酚酞溶液,搅拌均匀,观察溶液的颜色为色;从烧杯A中取少量溶液置于试管中,向其中慢慢滴加浓氨水,观察溶液的颜色变为红色.以上现象说明,能使酚酞溶液变红的物质是(填“空气”、“水”或“氨水”).
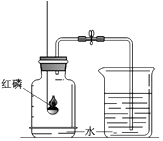
(2)【进行实验】另取一个小烧杯B,加入约5mL浓氨水.用一个大烧杯罩住A,B两个小烧杯(装置如图1).观察几分钟,填写下表:
烧杯A | 烧杯B | |
现象 |
(3)【实验结论】通过以上实验,主要能证明分子具有的一个性质是 .
(4)【拓展探究】该小组同学在玻璃管两端同时放入蘸有试剂的棉花,做了如图2所示实验,发现在玻璃管内形成了白色烟环(成分为氯化铵),且白色烟环偏向蘸有浓盐酸的棉花一端. 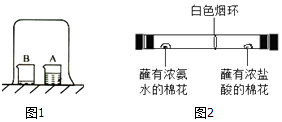
【现象分析】写出该反应的化学方程式:;白色烟环偏向蘸有浓盐酸的棉花一端的原因是 .
【答案】
(1)无;氨水
(2)溶液颜色变红;溶液颜色无明显变化
(3)分子总是在不断运动着
(4)NH3+HCl=NH4Cl;氨分子的运动速率大于氯化氢分子的运动速率
【解析】解:【实验准备】向盛有约20mL蒸馏水的小烧杯A中加入5~6滴酚酞溶液,搅拌均匀,观察溶液的颜色为 无色;从烧杯A中取少量溶液置于试管中,向其中慢慢滴加浓氨水,观察溶液的颜色变为红色.以上现象说明,能使酚酞溶液变红的物质是氨水.
【进行实验】由于氨水易挥发出氨气,氨气分子运动到A烧杯的溶液中形成了氨水,能使A中的酚酞试液变成红色.
【实验结论】通过以上实验,主要能证明分子具有的一个性质是分子总是在不断运动着;
【现象分析】氨气与氯化氢气体反应生成了氯化铵固体,该反应的化学方程式:NH3+HCl=NH4Cl;白色烟环偏向蘸有浓盐酸的棉花一端的原因是氨分子的质量小运动速率大于氯化氢分子的运动速率.
故答为【实验准备】无,氨水;
【进行实验】
烧杯A | 烧杯B | |
现象 | 溶液颜色变红 | 溶液颜色无明显变化 |
【实验结论】分子总是在不断运动着;
【现象分析】NH3+HCl=NH4Cl; 氨分子的运动速率大于氯化氢分子的运动速率.
酚酞试液显无色,氨水显碱性,能使酚酞试液变红色;氨气与氯化氢气体反应生成了氯化铵固体,分子运动的速率与分子的质量有关,质量小的运动的速率快,据此分析回答有关的问题.

 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】按要求填写相关内容
(1)填表
化学符号 |
| |
符号的意义 | 2个铜原子 |
(2)某物质的化学式为CS2 , 其名称是 .
(3)砒霜是最古老的毒物之一,也是药剂中治疗白血病的有效成分.它是砷元素(As)的+3价的氧化物,请写出砒霜的化学式 .
【题目】下列有关“物质——性质——用途”的叙述中,用途与性质不相关的是( )
序号 | 物质 | 性质 | 用途 |
A | 一氧化碳 | 还原性 | 冶炼金属 |
B | 氧气 | 助燃性 | 医疗急救 |
C | 氮气 | 稳定性 | 食品防腐 |
D | 干冰 | 升华时吸收热量 | 制冷剂 |
A.A
B.B
C.C
D.D