题目内容
【题目】某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从如图中选择装置进行了几种气体的制备实验. 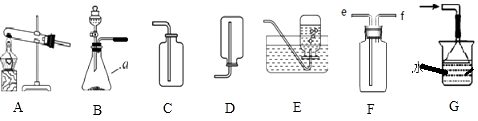
(1)写出仪器a的名称: .
(2)甲同学选择装置BE制氧气.能用E装置收集氧气的原因是 , 若先
用F装置收集氧气,氧气从导管(填“e”或“f”)进入.用分液漏斗相比较长颈漏斗的优点是 , 实验结束后,若将MnO2分离开来的操作是 , 用B装置还用于实验室制取CO2 , 该反应的符号表达式是 .
(3)乙同学实验发现,只用KClO3固体加热制取O2的反应速率很慢,但如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快.KClO3的分解速率大大加快的原因是 . 实验反思:通过以上实验探究,你对催化剂的认识是
A.MnO2只能作过氧化氢溶液分解的催化剂
B.催化剂在反应前后质量和性质都不变
C.催化剂能加快化学反应的速率,不影响生成物的量
D.用作催化剂的物质可能是其他反应的反应物或生成物.
【答案】
(1)锥形瓶
(2)O2不易溶于水;e;可控制反应速率;过滤;CaCO3+2HCl=CaCl2+CO2↑+H2O
(3)因为高锰酸钾分解也会产生氧气,同时产生的二氧化锰对氯酸钾的分解起催化作用;CD
【解析】解:(1)标号仪器是锥形瓶;(2)氧气可用排水法收集是因为氧气不易溶于水,氧气密度比空气大,所以应从长管进气;
分液漏斗相比较长颈漏斗而言,可控制液体的滴加速度,进而可控制反应速率;B装置属于固液常温型,说明是用过氧化氢制取氧气,反应生成水,二氧化锰是反应的催化剂,其质量在反应前后不变,而二氧化锰不溶于水,所以实验结束后,若将MnO2分离开来,可进行过滤的操作;实验室制取二氧化碳用大理石和稀盐酸常温反应,也可用此装置,反应的符号表达式是:CaCO3+2HCl=CaCl2+CO2↑+H2O;(3)如果将KMnO4固体与KClO3固体混合加热,则KClO3的分解速率大大加快.KMnO4在KClO3的分解反应中不是作催化剂,原因是加了高锰酸钾之后,产生氧气速度加快是因为高锰酸钾分解也会产生氧气,同时产生的二氧化锰对氯酸钾的分解起催化作用;
实验反思:A、MnO2还可以作为氯酸钾分解的催化剂,故A错误;
B、催化剂在反应前后质量和化学性质都不变,故B错误;
C、催化剂是改变反应速率,对生成物的质量多少没有影响,故C正确;
D、二氧化锰可以催化过氧化氢分解,也是高锰酸钾分解的生成物,故D正确;
故答案为:(1)锥形瓶;(2)O2不易溶于水;e;可控制反应速率;过滤;CaCO3+2HCl=CaCl2+CO2↑+H2O;(3)因为高锰酸钾分解也会产生氧气,同时产生的二氧化锰对氯酸钾的分解起催化作用;CD.
(1)依据实验室常用仪器的认识解决此题;(2)氧气可用排水法收集是因为氧气不易溶于水,氧气密度比空气大,所以应从长管进气;
分液漏斗相比较长颈漏斗而言,可控制液体的滴加速度,进而可控制反应速率;二氧化锰不溶于水;并据实验室制取二氧化碳的反应原理书写符号表达式;(3)根据高锰酸钾加热分解也会产生氧气解答;
根据催化剂在化学反应中的作用和本身性质进行分析.

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案【题目】某化学学习小组通过实验探究分子的性质.
(1)【查阅资料】氨气溶于水形成氨水,氯化氢气体溶于水形成盐酸;浓氨水和浓盐酸都具有很强的挥发性.
【实验准备】向盛有约20mL蒸馏水的小烧杯A中加入5~6滴酚酞溶液,搅拌均匀,观察溶液的颜色为色;从烧杯A中取少量溶液置于试管中,向其中慢慢滴加浓氨水,观察溶液的颜色变为红色.以上现象说明,能使酚酞溶液变红的物质是(填“空气”、“水”或“氨水”).
(2)【进行实验】另取一个小烧杯B,加入约5mL浓氨水.用一个大烧杯罩住A,B两个小烧杯(装置如图1).观察几分钟,填写下表:
烧杯A | 烧杯B | |
现象 |
(3)【实验结论】通过以上实验,主要能证明分子具有的一个性质是 .
(4)【拓展探究】该小组同学在玻璃管两端同时放入蘸有试剂的棉花,做了如图2所示实验,发现在玻璃管内形成了白色烟环(成分为氯化铵),且白色烟环偏向蘸有浓盐酸的棉花一端. 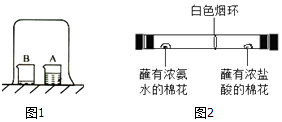
【现象分析】写出该反应的化学方程式:;白色烟环偏向蘸有浓盐酸的棉花一端的原因是 .