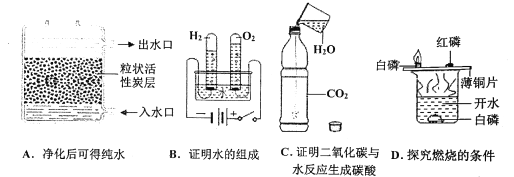
题目内容
【题目】通过化学实验可以认识物质的组成、性质与制取.
![]() 研究常见物质组成.
研究常见物质组成.
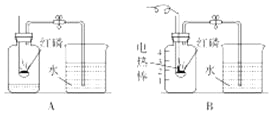
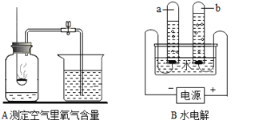
(1)A实验是用白磷测量空气中氧气含量,若未恢复至室温,则测量结果会_______(填偏大、偏小或不变)。
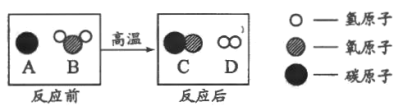
(2)B实验过程中,a管产生的气体是________,该反应化学方程式是_____________;根据两极生成的气体确定了水是由_______________组成的,得出此结论的理论依据是________________________,该过程中不变的微粒是_____________。
![]() 研究气体的制取、性质和收集
研究气体的制取、性质和收集
根据下列实验装置图,回答问题:
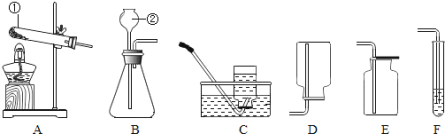
(1)写出标有序号的仪器名称:①________,②________;
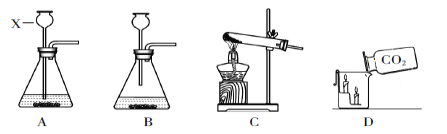
(2)小红想打算用过氧化氢溶液为原料,较快的制取并收集一瓶相对纯净的氧气,应选用上述装置组合是___________,该反应的方程式为______________________。二氧化锰在反应后是否可以回收再利用?_____(填是或否)。若用排空气法收集氧气,应选用上述装置中的______,原因是:_______________。
(3)化学兴趣小组的同学在研究氨气的性质时,做了下面两个实验:
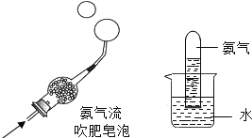
根据上述实验现象,写出氨气的两点性质__________、____________。
【答案】偏小 氢气 2H2O ![]() 2H2↑+O2↑ 氢元素、氧元素组成的 质量守恒定律 氢原子、氧原子 试管 长颈漏斗 BC 2H2O2
2H2↑+O2↑ 氢元素、氧元素组成的 质量守恒定律 氢原子、氧原子 试管 长颈漏斗 BC 2H2O2 ![]() 2H2O+O2↑ 是 E 氧气密度比空气大 密度比空气小 易溶于水
2H2O+O2↑ 是 E 氧气密度比空气大 密度比空气小 易溶于水
【解析】
[探究1]
(1)实验没有等到装置冷却至室温就打开止水夹,由于瓶内气体温度偏高,气压偏大,会导致测量结果小,故填:偏小;
(2)在实验过程中,a管与负极连接,产生的气体是氢气,电解水生成氢气和氧气,反应的化学方程式为:2H2O ![]() 2H2↑+O2↑,根据两极生成的气体确定了水是由氢元素、氧元素组成的,得出此结论的理论依据是质量守恒定律,该过程中不变的微粒是氢原子、氧原子;
2H2↑+O2↑,根据两极生成的气体确定了水是由氢元素、氧元素组成的,得出此结论的理论依据是质量守恒定律,该过程中不变的微粒是氢原子、氧原子;
[探究2]
(1)仪器①的名称为试管,仪器①的名称为长颈漏斗;
(2)用过氧化氢溶液为原料制取氧气为固液不加热型,并收集一瓶相对纯净的氧气,应选用上述装置组合是BC;该反应的方程式为2H2O2 ![]() 2H2O+O2↑;二氧化锰在反应中是催化剂,在化学变化前后质量和化学性质都不变,可以回收再利用;若用排空气法收集氧气,应选用上述装置中的E,原因是:氧气密度比空气大;
2H2O+O2↑;二氧化锰在反应中是催化剂,在化学变化前后质量和化学性质都不变,可以回收再利用;若用排空气法收集氧气,应选用上述装置中的E,原因是:氧气密度比空气大;
(3)根据上述实验现象,写出氨气的两点性质密度比空气小、易溶于水。