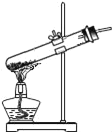
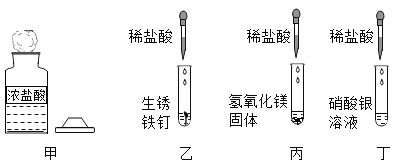
题目内容
【题目】常温下,氯酸钾的溶解度较小,在工业上可通过如下转化制得。
![]()
(1)实验室用KClO3制取氧气的化学方程式为 ________ .
(2)反应Ⅰ中,通电时发生的反应方程式为NaCl+3X ![]() NaClO3+3H2↑,则X的化学式为 _______ .
NaClO3+3H2↑,则X的化学式为 _______ .
(3)该转化中可以循环利用的物质是_______(填名称)
【答案】2KClO3![]() 2KCl+3O2
2KCl+3O2![]() H2O 氯化钠
H2O 氯化钠
【解析】
化学反应的过程就是原子重新组合的过程,反应前后原子的种类没有改变,原子的数目没有增减,原子的质量没有变化。
(1)实验室用KClO3和二氧化锰制取氧气,同时生成氯化钾,化学方程式为2KClO3![]() 2KCl+3O2
2KCl+3O2![]() 。
。
(2)反应Ⅰ中,通电时发生的反应方程式为NaCl+3X ![]() NaClO3+3H2↑,反应前钠原子、氯原子个数分别为1、1;反应后钠原子、氯原子、氧原子、氢原子个数依次为1、1、3、6,根据化学反应中,原子的种类、数目、种类不改变,则X的化学式为H2O。
NaClO3+3H2↑,反应前钠原子、氯原子个数分别为1、1;反应后钠原子、氯原子、氧原子、氢原子个数依次为1、1、3、6,根据化学反应中,原子的种类、数目、种类不改变,则X的化学式为H2O。
(3)原理是氯化钠,步骤ΙΙ转化中生成氯化钠,可以循环利用的物质是氯化钠。

 阅读快车系列答案
阅读快车系列答案【题目】实验室中的药品一般要密封保存,否则可能会与空气接触而变质.某研究性学习小组的同学对实验室里久置于空气中变质的过氧化钠(Na2O2)固体的成分进行探究.
(查阅资料)(1)Na2O2的化学性质很活泼,能与水、二氧化碳反应,相关反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2↑;
(2)CaCl2溶液为中性。
(提出问题)固体物质的成分可能为:
①:固体为Na2O2、NaOH、Na2CO3的混合物
②:固体为NaOH和Na2CO3的混合物
③:固体为NaOH
④:固体为Na2CO3
(实验探究)
实验操作 | 实验现象 | 实验结论 |
①取少量固体于试管中,加水振荡,直至完全溶解 | _____ | 猜想①不成立 |
②取少量①的溶液于试管中,滴加CaCl2溶液至过量 | _____ | 证明有Na2CO3存在 |
③ 取少量②的溶液于试管中,滴加几滴酚酞试液 | _____ | 证明有NaOH存在 |
综合以上实验现象,说明猜想II是成立的. | ||
(反思评价)
(1)实验操作②中反应的化学方程式为_____.
(2)实验操作②中“滴加CaCl2溶液至过量”的目的是_____.