جâؤ؟ؤعبف
،¾جâؤ؟،؟¶ش±ب·ضخِتا»¯ر§رذ¾؟؛حر§ذ£µؤ»ù±¾·½·¨£¬خھءثرéض¤»¯ر§·´س¦تا·ٌ×ٌتطضتء؟تط؛م¶¨آة£¬¼×،¢زز،¢±ùب¸ِذثب¤ذ،×éµؤح¬ر§·ض±ًةè¼ئءثبçح¼ثùت¾µؤتµر飮 
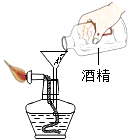
،¾تµرé²½ضè،؟بçح¼ثùت¾£¬¼×،¢ززء½×éح¬ر§·ض±ً°رت¢سذتتء؟NaOH،¢H2O2بـز؛µؤذ،تش¹ـ·إبëت¢سذCuSO4بـز؛،¢MnO2بـز؛µؤةص±ضذ£¬²¢½«ةص±·إµ½جىئ½ةدµ÷ضءئ½؛⣬½س×إب،دآةص±²¢½«ئنامذ±£¬ت¹خïضت»ى؛د·¢ةْ·´س¦£¬´·´س¦؛َشظ°رةص±·إµ½جىئ½ةد£¬¹غ²ىجىئ½تا·ٌئ½؛⣬±û×éح¬ر§ب،ز»¸ù´ٍؤ¥¸ة¾»µؤد¸جْث؟؛حز»¸ِت¯أقحّ£¬½«ثüأاز»ئً·إشعحذإججىئ½ةد£¬سأيہآëئ½؛⣬ب،دآجْث؟£¬½«جْث؟·إشع³نآْرُئّµؤ¼¯ئّئ؟ضذµمب¼£¬ب¼ةص½لتّ²¢ہنب´؛َ½«ثùµأµؤخïضتسëت¯أقحّز»ئًشظ·إ»طحذإججىئ½ةد³ئء؟£®
£¨1£©،¾تµرé·ضخِ،؟ اëؤم·آصصت¾ہ£¬حê³ةتµرéدضدَµؤ¼اآ¼؛ح·ضخِ£®
تµرéدضدَ | »¯ر§·½³جت½ | ½لآغ | |
¼××é | ²ْةْہ¶ة«³ءµي£¬جىئ½¢ظ£¨جî،°ئ½؛â،±»ٍ،°²»ئ½؛â،±£© | ¢ع | ¸أ·´س¦×ٌتطضتء؟تط؛م¶¨آة |
زز×é | ةص±ضذ²ْةْ´َء؟ئّإف£¬جىئ½²»ئ½؛â | ¢غ | ¸أ·´س¦²»×ٌتطضتء؟تط؛م¶¨آة |
±û×é | ¢ـ £¬ ·´س¦ا°؛َ³ئء؟ضتء؟²»دàµب | 3Fe+2O2 | ¸أتµرé×ٌتطضتء؟تط؛م¶¨آة |
£¨2£©ح¨¹¶شةدتِتµرéµؤ¶ش±ب·ضخِ£¬¼×±ûء½×éح¬ر§·¢دضززح¬ر§µؤ½لآغتاصب·µؤ£¬µ«½لآغب´تا´يخَµؤ£®شعتµرé²ظ×÷حêب«صب·µؤاé؟ِدآ£¬اë·ضخِµ¼ضآزز×éتµرéتµرé·´س¦؛َجىئ½²»ئ½؛âµؤشزٍ £®
£¨3£©،¾تµرé½لآغ،؟»¯ر§·´س¦¶¼×ٌتطضتء؟تط؛م¶¨آة£® ،¾تµرé·´ث¼،؟´سخ¢¹غ½ا¶ب·ضخِ»¯ر§·´س¦×ٌتطضتء؟تط؛م¶¨آةµؤشزٍتا£؛»¯ر§·´س¦ا°؛َ£¬ش×سµؤضتء؟،¢،¢¾ù²»±ن£®
،¾´ً°¸،؟
£¨1£©ئ½؛⣻2NaOH+CuSO4=Cu£¨OH£©2،+Na2SO4£»2H2O2 ![]() 2H2O+O2،ü£»¾çءزب¼ةص£¬»ًذاثؤةن£¬ةْ³ة؛عة«¹ججه
2H2O+O2،ü£»¾çءزب¼ةص£¬»ًذاثؤةن£¬ةْ³ة؛عة«¹ججه
£¨2£©·´س¦ةْ³ةµؤرُئّزفة¢µ½؟صئّضذ£¬ضتء؟¼ُةظ
£¨3£©ضضہࣻتؤ؟
،¾½âخِ،؟½â£؛£¨1£©سةسع¼×ذ،×éسأءٍثلحسëاâرُ»¯ؤئ·´س¦£¬ةْ³ةءٍثلؤئ؛حاâرُ»¯ح£¬أ»سذخïضتإـ³ِ£¬ضتء؟²»±نجىئ½ض¸صëض¸دٍ؟ج¶بإجµؤضذ¼ن£»»¯ر§·½³جت½خھ£؛2NaOH+CuSO4=Cu£¨OH£©2،+Na2SO4£»ززذ،×éسأµؤتا¹رُ»¯اâ؛ح¶رُ»¯أج·´س¦ةْ³ةرُئّ؛حث®£¬سذئّجهإـ³ِضتء؟¼ُةظ£¬جىئ½²»ئ½؛⣬»¯ر§·½³جت½خھ£؛2H2O2 ![]() 2H2O+O2،ü£»±û×éح¬ر§جْث؟·إشع³نآْرُئّµؤ¼¯ئّئ؟ضذµمب¼£¬تµرéدضدَتا£؛¾çءزب¼ةص£¬»ًذاثؤةن£¬ةْ³ة؛عة«¹ججه£®£¨2£©ززذ،×éسأµؤتا¹رُ»¯اâ؛ح¶رُ»¯أج·´س¦ةْ³ةرُئّ؛حث®£¬سذئّجهإـ³ِضتء؟¼ُةظ£¬جىئ½²»ئ½؛⣻£¨3£©،¾تµرé·´ث¼،؟´سخ¢¹غ½ا¶ب·ضخِ»¯ر§·´س¦×ٌتطضتء؟تط؛م¶¨آةµؤشزٍتا£؛»¯ر§·´س¦ا°؛َ£¬ش×سµؤضتء؟ضضہà،¢تؤ؟¾ù²»±ن£® ثùزش´ً°¸تا£؛£¨1£©ئ½؛⣻2NaOH+CuSO4=Cu£¨OH£©2،+Na2SO4|2H2O2
2H2O+O2،ü£»±û×éح¬ر§جْث؟·إشع³نآْرُئّµؤ¼¯ئّئ؟ضذµمب¼£¬تµرéدضدَتا£؛¾çءزب¼ةص£¬»ًذاثؤةن£¬ةْ³ة؛عة«¹ججه£®£¨2£©ززذ،×éسأµؤتا¹رُ»¯اâ؛ح¶رُ»¯أج·´س¦ةْ³ةرُئّ؛حث®£¬سذئّجهإـ³ِضتء؟¼ُةظ£¬جىئ½²»ئ½؛⣻£¨3£©،¾تµرé·´ث¼،؟´سخ¢¹غ½ا¶ب·ضخِ»¯ر§·´س¦×ٌتطضتء؟تط؛م¶¨آةµؤشزٍتا£؛»¯ر§·´س¦ا°؛َ£¬ش×سµؤضتء؟ضضہà،¢تؤ؟¾ù²»±ن£® ثùزش´ً°¸تا£؛£¨1£©ئ½؛⣻2NaOH+CuSO4=Cu£¨OH£©2،+Na2SO4|2H2O2 ![]() 2H2O+O2،ü£»¾çءزب¼ةص£¬»ًذاثؤةن£¬ةْ³ة؛عة«¹ججه£¨2£©·´س¦ةْ³ةµؤرُئّزفة¢µ½؟صئّضذ£¬ضتء؟¼ُةظ£»£¨3£©،¾تµرé·´ث¼،؟ضضہà،¢تؤ؟£®
2H2O+O2،ü£»¾çءزب¼ةص£¬»ًذاثؤةن£¬ةْ³ة؛عة«¹ججه£¨2£©·´س¦ةْ³ةµؤرُئّزفة¢µ½؟صئّضذ£¬ضتء؟¼ُةظ£»£¨3£©،¾تµرé·´ث¼،؟ضضہà،¢تؤ؟£®
،¾؟¼µم¾«خِ،؟½â´ً´ثجâµؤ¹ط¼üشعسعہي½âتéذ´»¯ر§·½³جت½،¢خؤ×ض±ي´ïت½،¢µçہë·½³جت½µؤدà¹طضھت¶£¬صئخص×¢زâ£؛a،¢إنئ½ b،¢جُ¼ c،¢¼؛إ£®

 ±¸ص½ضذ؟¼؛®¼ظدµءذ´ً°¸
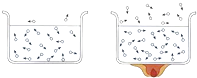
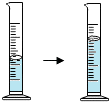
±¸ص½ضذ؟¼؛®¼ظدµءذ´ً°¸،¾جâؤ؟،؟¶شدآءذتµرéدضدَ½ّذذµؤ½âتح´يخَµؤتا£¨ £©
A£® | B£® | C£® | D£® | |
تµرé |
|
|
|
|
½â تح | ·ض×سµؤضتء؟؛حجه»¶¼؛ـذ، | ·ض×س×ـتاشع²»¶دشث¶¯×إ | ³£خآت±·ض×س²»شث¶¯£¬ | ·ض×س¼نسذ¼ند¶ |
A.A
B.B
C.C
D.D