题目内容
【题目】根据如图所示实验回答问题:
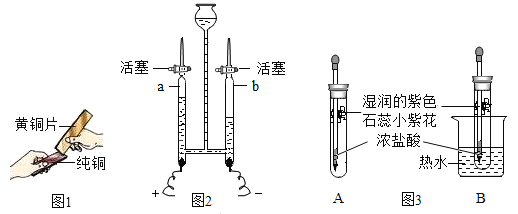
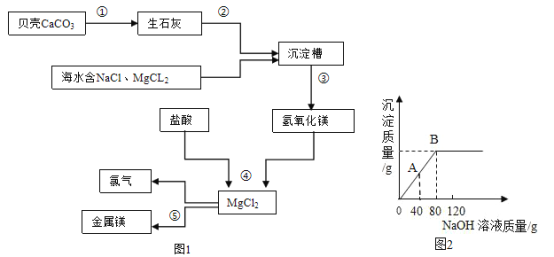
![]() 图1是将纯铜片和黄铜片互相刻划,纯铜片上留下明显的划痕,该现象说明______。
图1是将纯铜片和黄铜片互相刻划,纯铜片上留下明显的划痕,该现象说明______。
![]() 图2是电解水实验,实验中检验a管内产生气体的方法是______。
图2是电解水实验,实验中检验a管内产生气体的方法是______。
![]() 图3是探究分子性质的实验。挤出浓盐酸,A中观察到的现象是______,设计A、B两个实验的目的是______。
图3是探究分子性质的实验。挤出浓盐酸,A中观察到的现象是______,设计A、B两个实验的目的是______。
【答案】黄铜的硬度比纯铜的硬度大 打开a管的活塞,将带火星木条放在尖嘴处,若木条复燃,a管内气体是氧气 润的紫色石蕊小紫花变红色 研究温度对分子运动速率的影响
【解析】
根据合金的性能比组成的纯金属的性能优良进行分析; 根据氧气检验方法考虑; 根据盐酸显酸性,能使紫色石蕊试液变红色考虑;对照实验中变量是温度,再进一步分析即可。解答本题关键是熟悉分子的性质,知道酸能使石蕊变红色。
![]() 合金的性能比组成的纯金属的性能优良,所以将纯铜片好黄铜片互相刻划,纯铜片上留下明显的划痕,说明:黄铜的硬度比纯铜的硬度大;
合金的性能比组成的纯金属的性能优良,所以将纯铜片好黄铜片互相刻划,纯铜片上留下明显的划痕,说明:黄铜的硬度比纯铜的硬度大;
![]() 打开a管的活塞,将带火星木条放在尖嘴处,若木条复燃,a管内气体是氧气;
打开a管的活塞,将带火星木条放在尖嘴处,若木条复燃,a管内气体是氧气;
![]() 盐酸显酸性,能使紫色石蕊试液变红色,挤出浓盐酸后,氯化氢分子在不断运动,与湿润的紫色石蕊小紫花中的水分接触,形成盐酸,紫色小紫花变红色,说明了分子在不断运动;对照AB实验可知,二者设计的温度不同,所以目的是研究温度对分子运动速率的影响。
盐酸显酸性,能使紫色石蕊试液变红色,挤出浓盐酸后,氯化氢分子在不断运动,与湿润的紫色石蕊小紫花中的水分接触,形成盐酸,紫色小紫花变红色,说明了分子在不断运动;对照AB实验可知,二者设计的温度不同,所以目的是研究温度对分子运动速率的影响。
故答案为:![]() 黄铜的硬度比纯铜的硬度大;
黄铜的硬度比纯铜的硬度大;![]() 打开a管的活塞,将带火星木条放在尖嘴处,若木条复燃,a管内气体是氧气;
打开a管的活塞,将带火星木条放在尖嘴处,若木条复燃,a管内气体是氧气;![]() 湿润的紫色石蕊小紫花变红色;研究温度对分子运动速率的影响。
湿润的紫色石蕊小紫花变红色;研究温度对分子运动速率的影响。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案【题目】“石头纸”就是用磨成粉末的石头为主要原料做成的。这种纸防水坚固不易燃烧,最重要的是不用砍树造纸,非常环保。日程表、便签纸等东西都是以碳酸钙为主要原料的低碳“石头纸”。为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与水和盐酸反应):
烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ | |
加入样品的质量/g | 10 | 10 | 10 | 10 | 10 |
加入稀盐酸的质量/g | 10 | 20 | 30 | 40 | 50 |
充分反应后生成气体的质量/g | 0.88 | 1.76 | X | 3.52 | 3.52 |
(1)表中X的值为________;
(2)在烧杯_______中碳酸钙完全反应;
(3)求样品中碳酸钙的质量分数_____。
【题目】某小组同学通过资料发现,向不同浓度的碳酸钠和碳酸氢钠溶液中加入氯化钙溶液,会出现以下现象。继而对氯化钙与两种溶液的反应进行了探究。
Na2CO3 | NaHCO3 | |
现象一 | 产生沉淀 | 产生沉淀和气泡 |
现象二 | 产生沉淀 | 产生沉淀 |
现象三 | 产生沉淀 | 无沉淀 |
(查阅资料)
①![]()
②Ca(HCO3)2易溶于水。
(进行实验)
实验一:70℃恒温水浴下,向10 mL不同浓度的Na2CO3和NaHCO3溶液中滴加10%的CaCl2溶液,现象如下表。
浓度 | Na2CO3 | NaHCO3 |
10% | 滴加1滴出现白色沉淀 | 滴加1滴出现白色沉淀,有较多气泡产生 |
5% | 滴加1滴出现白色沉淀 | 滴加1滴出现白色沉淀,30 s后有少量气泡产生 |
1% | 滴加1滴出现白色沉淀 | 滴加10滴出现浑浊 |
0.5% | 滴加1滴出现白色沉淀 | 滴加52滴出现浑浊 |
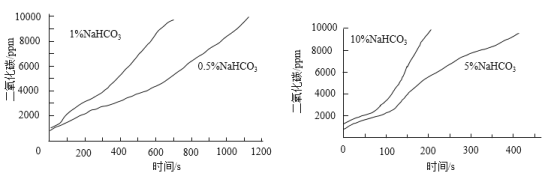
实验二:如图进行实验。70℃恒温水浴下,向10 mL不同浓度的NaHCO3溶液中滴加10%的CaCl2溶液,测得CO2浓度与时间的关系如下图。

(解释与结论)
(1)NaHCO3的俗称是________。
(2)![]() 属于基本反应类型中的________反应。
属于基本反应类型中的________反应。
(3)补全NaHCO3与CaCl2反应的化学方程式:![]() +________+________+H2O。
+________+________+H2O。
(4)实验二得出的结论是________。
(反思与评价)
(5)实验一中,向NaHCO3溶液中滴加CaCl2溶液时,有些只观察到浑浊、未观察到气泡,原因可能是________。
(6)小组同学发现的资料,现象三的NaHCO3溶液中无沉淀,其原因可能为_______。
【题目】除去下列物质中的少量杂质,所用试剂和操作方法均正确的是( )
选项 | 物质 | 所用试剂和操作方法 |
A | N2(O2) | 通过灼热的木炭 |
B | KC1固体(MnO2) | 加入适量水溶解,过滤,洗涤,干燥 |
C | NaNO3溶液(CuSO4) | 加入过量Ba(NO3)2溶液,过滤 |
D | Cu(NO3)2溶液(HNO3) | 加入过量氧化铜粉末,过滤 |
A.AB.BC.CD.D