题目内容
【题目】如图是实验室中常见装置,回答下列问题。

(1)仪器a的名称是_____。
(2)用装置A进行实验时,首先应_____(填序号)。
①加药品②加热③检查装置气密性
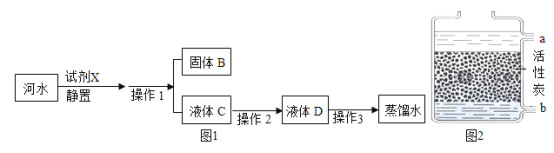
(3)若要收集干燥的CO2,可将含有水蒸气的CO2从装置B的_____(填“m”成“n”)端导入,试剂X是_____;再用装置_____(填“C”或“D”或“E”)收集。
(4)向集满CO2的集气瓶中加入澄清石灰水,反应的化学方程式为_____。
【答案】锥形瓶 ③ m 浓硫酸 E ![]()
【解析】
(1)由图可知,仪器a的名称是锥形瓶;
(2)制取气体时,为防止装置漏气,影响实验效果,实验前应先检查装置气密性,故填③;
(3)收集干燥的CO2,为了使用混合气体与干燥剂充分接触,应将含有水蒸气的CO2从装置B的长管,即m端通入到干燥剂中,使水蒸气被充分吸收,故填m;浓硫酸具有吸水性,所以可用浓硫酸作为干燥剂来干燥气体,故填浓硫酸;氧气的密度大于空气的密度,所以再用向上排空气法收集干燥后的氧气,故填E;
(5)二氧化碳能与澄清石灰水中的氢氧化钙反应生成水和碳酸钙沉淀,使澄清石灰水变浑浊,故反应的化学方程式写为:CO2+Ca(OH)2= CaCO3↓+H2O。

 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案【题目】某校化学兴趣小组对如何鉴别生活中的苏打(Na2CO3)和小苏打(NaHCO3),进行了下列探究: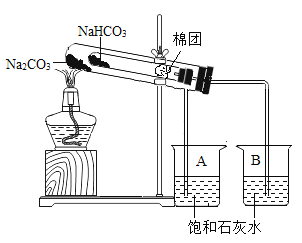
(查阅资料)
①相同条件下,碳酸钠溶液比碳酸氢钠溶液的碱性强;
②270℃时,NaHCO3会完全分解生成二氧化碳、水及一种白色固体,而Na2CO3不易分解:
③常见的碳酸盐中,只有碳酸钠、碳酸钾和碳酸铵溶于水,其它碳酸盐大多不溶于水。
(实验探究)
(1)充分加热后,A、B两烧杯中的现象分别为__、__、__,由此可得出的结论是__。
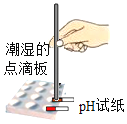
(2)现有浓度相同的Na2CO3与NaHCO3溶液,充分利用所学知识和资料,你认为区分二者最简单的方法是__。
A 加热 B 用pH试纸测溶液pH C 滴加稀盐酸
(反思与评价)
(1)常用小苏打治疗轻度胃酸过多的病人,原因是___(用化学方程式表示)。
(2)检验碳酸钠粉未中是否含有碳酸氢钠的方法是____。
(拓展延伸)该兴趣小组同学认为,充分加热NaHCO3后的白色固体产物可能是NaOH或Na2CO3。
(1)他们猜想的依据是_____。
(2)设计实验检验反应后的固体产物是NaOH还是Na2CO3,并完成下表(限选试剂及仪器:稀盐酸、氯化钡溶液、澄清石灰水、酚酞试液、蒸馏水、试管、胶头滴管)。
序号 | 实验操作 | 实验现象 | 实验结论 |
① | 取少量加热后的固体产物于试管A中,加入适量蒸馏水并充分振荡溶解,再加入足量____,振荡,静置 | 产生白色沉淀 | 产物中含有Na2CO3 |
② | 取操作①后的上层清液于试管B中,滴加_____ | _____ | 产物中不含NaOH |