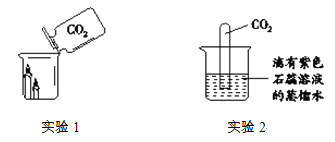
题目内容
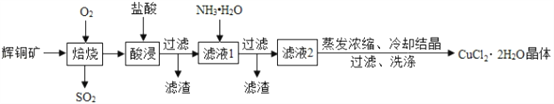
【题目】某课外小组用废弃白铜(Cu、Ni)粉末分离得到Cu、Ni两种金属,其主要流程如下(部分反应产物在图中已略去):
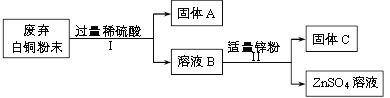
已知:Ni与Fe化学性质相似,常见化合价为+2价。
(1)固体A的化学式是______。
(2)ZnSO4中硫元素的化合价是______。
(3)I中反应的化学方程式是______。
(4)II中分离出固体C的操作名称是______。
(5)由上述流程得出Cu、Ni、Zn的金属活动性由强到弱的顺序是______。
【答案】 Cu +6 Ni + H2SO4 === NiSO4 + H2↑ 过滤 Zn、Ni、Cu
【解析】(1)根据固液分离可知,A物质是铜,据此分析解答;(2)根据化合物中各元素正负化合价代数和为0解答;(3)根据反应I是镍与稀硫酸反应,生成硫酸镍和氢气解答;(4) 根据固液分离分析解答;(5)根据铜不与稀硫酸反应而镍与稀硫酸反应生成硫酸镍及锌能置换出硫酸镍中的镍分析解答。(1)固体A的化学式是Cu;(2)ZnSO4中硫元素的化合价是0-(-2)×4-(+2)=+6;(3)反应I是镍与稀硫酸反应,生成硫酸镍和氢气,反应的化学方程式是Ni + H2SO4 =NiSO4 + H2↑;(4)由图可知,II是将固体从液体中分离出来,故II的操作名称是过滤;(5)铜不与稀硫酸反应而镍与稀硫酸反应生成硫酸镍,说明镍的活动性比铜强。锌能置换出硫酸镍中的镍,得到硫酸锌溶液,说明锌的活动性比镍强。故Cu、Ni、Zn的金属活动性由强到弱的顺序是Zn、Ni、Cu。

练习册系列答案
相关题目