题目内容
【题目】一种“环保石头纸”开始被人们使用,其主要成分是碳酸钙。某班同学对它产生了浓厚的兴趣把“环保石头纸”带到实验室,完成了如图所示两个实验。请回答下列问题:
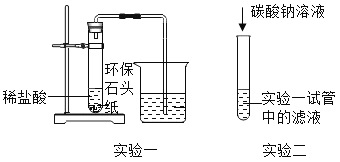
(1)实验一:试管中产生大量的气泡,烧杯中澄清的石灰水变浑浊,请写出“环保石头纸”与稀盐酸发生的反应的化学方程式____(假设“环保石头纸”中的其他的成分既不溶于水,又不与盐酸反应)。
(2)实验二:试管中有白色沉淀产生。小刚同学想探究该实验反应后溶液中溶质的成分。
提出猜想:
猜想Ⅰ:NaCl、CaCl2和HCl;猜想Ⅱ:NaCl和CaCl2;猜想Ⅲ:_____
同学们经过讨论排除了猜想____,理由是_____
有同学认为小刚的猜想不全面,又提出猜想Ⅳ:NaCl和Na2CO3,并通过实验验证了该猜想成立。请你将实验报告补充完整。
实验操作 | 实验现象 | 实验结论 |
取实验二反应后的上层清液少量于试管中,滴加少量____ | ______ | 猜想Ⅳ成立 |
(3)实验结束后,未经处理的废液_____(填“能”或“不能”)直接倒入下水道。
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑ NaCl Ⅰ 稀盐酸能与试管中的白色沉淀继续反应 稀盐酸 有气泡产生 不能
【解析】
(1)稀盐酸与碳酸钙反应原理:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)碳酸钠与实验一中的滤液恰好完全反应,Na2CO3+CaCl2=2NaCl+CaCO3↓此时溶质的成分,猜想Ⅲ:只有氯化钠;同学们经过讨论排除了猜想Ⅰ,因为稀盐酸能与试管中的白色沉淀继续反应,两者不能共存;
猜想Ⅳ:溶液中的溶质有NaCl和Na2CO3,取实验二反应后的上层清液少量于试管中,滴加少量稀盐酸,稀盐酸与碳酸钠反应原理:Na2CO3+2HCl=2NaCl+H2O+CO2↑有气泡产生,则溶液中一定有碳酸钠。猜想Ⅳ成立;实验结束后的未经处理的废液不能直接倒入下水道,应倒入指定容器;

 一本好题口算题卡系列答案
一本好题口算题卡系列答案