题目内容
【题目】为分析某由氧化铜和铜组成的混合物中氧化铜的质量分数,现取3份该混合物各20 g,分别缓慢加入到50 g、100 g、150 g某稀硫酸中,测得三组实验数据如表:
组别 | 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 |
稀硫酸的质量/g | 50 | 100 | 150 |
溶解固体的质量/g | 10.0 | 16.0 | 16.0 |
根据实验及有关数据进行分析与计算:
(1)第Ⅰ组实验中反应物______________(填“氧化铜”“稀硫酸”或“氧化铜与稀硫酸”)反应完。
(2)20 g样品中含氧化铜的质量为________g。
(3)根据第Ⅰ组数据计算所用的稀硫酸溶质的质量分数(写出计算过程)。
(4)将第Ⅱ组混合物过滤,在滤液中滴加10%的NaOH溶液,画出在该混合溶液中加入10% NaOH溶液的质量与生成沉淀质量变化关系的曲线图。

【答案】(1)稀硫酸;(2)16.0;(3)24.5%;(4)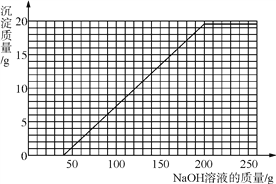
【解析】(1)据表中数据分析可知,20 g混合物中含有16 g的氧化铜,第Ⅰ组实验中反应物硫酸反应完,氧化铜有剩余。(2)20 g样品中含氧化铜的质量为16g。(3)第Ⅰ组反应掉的CuO的质量为10g,设第Ⅰ组数据所用的稀硫酸溶质的质量为x,
CuO+H2SO4= CuSO4+H2O
80 98
10g x
![]() =
= ![]() 解得x= 12.25g
解得x= 12.25g
所用稀硫酸溶质的质量分数为:
![]() ×100%=24.5%
×100%=24.5%
(4)第Ⅰ组实验中50g稀硫酸反应掉10gCuO,第Ⅱ组实验中反应掉16gCuO,说明第Ⅱ组实验中稀硫酸有剩余。设16gCuO反应掉的稀硫酸溶液的质量为y,生成 CuSO4的质量为z,
CuO + H2SO4 = CuSO4+H2O
80 98 160
16g y![]() 24.5% z
24.5% z
![]() =
= ![]() 解得y=80g
解得y=80g ![]() =
=![]() 解得z=32g
解得z=32g
故第Ⅱ组实验中剩余稀硫酸溶液的质量为:100g-80g=20g,设与20g稀硫酸溶液反应的NaOH溶液的质量为w,
2NaOH + H2SO4=Na2SO4+2H2O
80 98
w×10% 20g×24.5%
![]() =
= ![]() 解得w= 40g
解得w= 40g
故加入10% NaOH溶液40g 以后才产生沉淀。设32g CuSO4与NaOH溶液反应生成氢氧化铜的质量为m,消耗NaOH溶液的质量为n
2NaOH + CuSO4= Cu(OH)2↓+ Na2SO4
80 160 98
n×10% 32g m
![]() =
=![]() 解得n=160g
解得n=160g
![]() =
=![]() 解得m=19.6g
解得m=19.6g
即曲线图的横坐标中从40g处开始产生沉淀,到200g处沉淀不再增多,沉淀的最大质量是19.6g。