题目内容
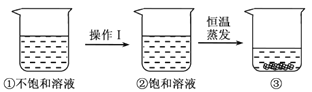
【题目】20℃时,向下列3只盛有100g水的烧杯中,分别加入40g三种固体,充分溶解。
温度/℃ | NaCl | KNO3 | NaNO3 |
20 | 36.0g | 31.6g | 88g |
60 | 37.3g | 110g | 125g |
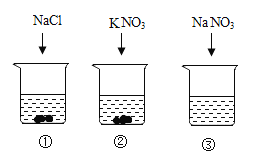
上述溶液为饱和溶液的是
A.①②B.②C.③D.①②③
【答案】A
【解析】
固体的溶解度是指在一定温度下,某固态物质在100g水中达到饱和状态时所溶解的质量;
①20℃时,NaCl的溶解度分别为36g,也就是100g水中只要溶解36gNaCl就达到饱和状态,在100g水中加入40gNaCl,故该溶液达到饱和状态;
②20℃时,KNO3溶解度是31.6g,也就是100g水中只要溶解31.6g KNO3就达到饱和状态,在100g水中加入40g KNO3,故该溶液达到饱和状态;
③20℃时,NaNO3的溶解度是88g,也就是100g水中只要溶解88g NaNO3就达到饱和状态,在100g水中加入40g NaNO3,故该溶液没有达到饱和状态;
20℃时,向三只盛有100g水的烧杯中,分别加入40g三种固体,充分溶解,达到饱和状态,形成饱和溶液的是①②。
故选:A。

 阅读快车系列答案
阅读快车系列答案【题目】电石是一种重要的化工原料。同学们借助网络资源和化学实验对电石的性质和变化进行如下的科学探究,请你也参与其中。
(查阅资料)
①电石的主要成分为碳化钙(化学式为CaC2),碳化钙与水反应生成一种白色固体和一种可燃性气体。
②将紫甘蓝汁液分别滴入下列液体中,显示的颜色如下表:
液体名称 | 白醋 | 食盐溶液 | 肥皂水 | 纯碱溶液 |
紫甘蓝汁液显示的颜色 | 红色 | 蓝紫色 | 蓝色 | 绿色 |
(作出猜想)根据碳化钙及水的组成推测:①碳化钙与水反应生成的白色固体可能是___________(写出两种物质)。
②碳化钙与水反应生成的可燃性气体可能是H2、CH4或C2H2(乙炔)。
(实验探究)同学们在老师的指导下,按如下步骤进行实验:
(1)取适量的电石加水,剧烈反应,放出大量的热,产生无色气体。
(2)收集反应生成的气体,验纯后点燃,发现气体燃烧时产生黄色火焰并伴有浓烈黑烟,因此该气体不可能是_____________。
(3)分别取反应生成的白色固体于两支试管中,进行如下的操作:
实验操作 | 实验现象 | 实验结论 |
①向一支试管中滴加足量的稀盐酸 | 固体溶解,但无气体产生 | 白色固体是________ |
②向另一支试管中加入适量的水,振荡、静置,再向上层清液中滴加_________ | 溶液变为绿色 |
(实验结论)碳化钙与水反应的化学方程式为___________。
(问题交流)
(1)存放电石的库房若发生火灾,___________(填“能”或“不能”)用水扑救。
(2)乙炔(C2H2)含碳量极高,它在空气中燃烧会冒出浓厚的黑烟(炭黑)。要使乙炔气体充分燃烧,常采用的方法是_____________。